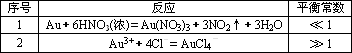题目内容
Ⅰ.将a g金属锡样品溶于盐酸中.
Ⅱ.向上述溶液中加入过量的FeCl3溶液(发生的反应为:Sn2++2Fe3+=Sn4++2Fe2+).
Ⅲ.用b mol/L的K2Cr2O7溶液滴定生成的Fe2+,共用去K2Cr2O7 溶液m mL.
请回答:
(1)Ⅰ中发生反应的离子方程式
(2)已知酸性环境下,Cr2O72- 可被还原为Cr3+,则Ⅲ中反应的离子方程式是:
(3)样品中锡的质量分数是
| 3bmM |
| 1000a |
| 3bmM |
| 1000a |
(2)反应中Cr2O72- 被还原为Cr3+,Fe2+被氧化Fe3+,同时生成水,配平书写离子方程式.
(3)根据关系式3Sn~3Sn2+~6Fe2+~Cr2O72-计算Sn的物质的量,进而计算Sn的质量,根据定义计算Sn的质量分数.
故答案为:Sn+2H+=Sn2++H2↑.
(2)反应中Cr2O72- 被还原为Cr3+,Fe2+被氧化Fe3+,同时生成水,
反应离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
(3)令样品中Sn物质的量为nmol,则:
3Sn~3Sn2+~6Fe2+~Cr2O72-.
3 1
nmol b mol/L×m×10-3L
解得n=3×b×m×10-3mol,
故样品中Sn的质量为3×b×m×10-3mol×Mg/mol=3×b×m×10-3×Mg
所以样品中Sn的质量分数为
| 3×b×m×M×10-3g |
| ag |
| 3bmM |
| 1000a |
故答案为:
| 3bmM |
| 1000a |

 阅读快车系列答案
阅读快车系列答案(14分)不同的金属在化学反应中表现出来的活泼程度不同,瑞典化学家贝采里乌斯和俄国化学家贝开托夫称之为金属活动顺序。另一方面,同一金属在不同条件或不同化学反应中也可以表现出不同的活泼程度。
⑴根据金属活动性顺序,工业上冶炼金属可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属有 。
腐蚀速率/g.m-2.h-1
 ⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
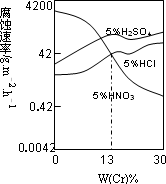
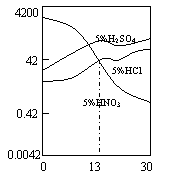
⑶合金Fe-Cr在不同酸中反应情况不同,其在三种稀硫
酸、稀硝酸和稀盐酸中的腐蚀速率如图所示,则下列
有关说法正确的是 (填写序号)。
A.酸的氧化性越强,对该合金的腐蚀速率越大
B.稀硝酸对该合金的腐蚀性比另两种酸弱
C.合金中Cr含量增加,稀硝酸对该合金的腐蚀性减弱
⑷已知粗铜中含有少量的锌、铁、银、金等金属和少量
|
以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,
并对阳极泥和电解液中金属进行回收。
步骤一:电解精制
电解时,粗铜应与电源的 极相连。电解过程中,硫酸铜的浓度会 (填“变大”、“不变”或“变小”)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl- = AuCl4- | >>1 |
从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因: 。