题目内容
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA |
| B、标准状况下,22.4mL Br2所含的分子数为0.001NA |
| C、标准状况下,22.4L的Cl2与1molFe充分反应,转移的电子数为3NA |
| D、100mL 0.1mol?L-1的H2SO3溶液中,H+总数为0.02 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.NO2或N2O4的最简式为NO2,根据二者的最简式计算出混合气体中含有的原子总数;
B.标准状况下,溴为液体,不能使用标况下的气体摩尔体积计算溴的物质的量;
C.标况下22.4L氯气的物质的量为1mol,lmol氯气与铁完全反应达到2mol电子;
D.亚硫酸为弱酸,溶液中只能部分电离出氢离子.
B.标准状况下,溴为液体,不能使用标况下的气体摩尔体积计算溴的物质的量;
C.标况下22.4L氯气的物质的量为1mol,lmol氯气与铁完全反应达到2mol电子;
D.亚硫酸为弱酸,溶液中只能部分电离出氢离子.
解答:
解:A.4.6gNO2或N2O4的混合物中含有0.1mol最简式NO2,含有0.3mol原子,混合气体中所含原子总数均为0.3NA,故A正确;
B.标况下,溴不是气体,不能使用标况下的气体摩尔体积计算22.44mL溴的物质的量,故B错误;
C.标准状况下22.4L氯气的物质的量为1mol,1mol氯气与铁完全反应需要得到2mol电子,根据电子守恒,转移的电子数为2NA,故C错误;
D.100mL 0.1mol?L-1的H2SO3溶液中含有溶质亚硫酸0.01mol,由于亚硫酸为弱酸,溶液中只能部分电离出氢离子,所以溶液中氢离子的物质的量小于0.02mol,溶液中的H+总数小于0.02 NA,故D错误;
故选A.
B.标况下,溴不是气体,不能使用标况下的气体摩尔体积计算22.44mL溴的物质的量,故B错误;
C.标准状况下22.4L氯气的物质的量为1mol,1mol氯气与铁完全反应需要得到2mol电子,根据电子守恒,转移的电子数为2NA,故C错误;
D.100mL 0.1mol?L-1的H2SO3溶液中含有溶质亚硫酸0.01mol,由于亚硫酸为弱酸,溶液中只能部分电离出氢离子,所以溶液中氢离子的物质的量小于0.02mol,溶液中的H+总数小于0.02 NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下的气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意标况下溴不是气体.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应不属于消去反应的是( )
A、CH3CH2OH
| |||
B、CH3CHBrCH3+NaOH
| |||
C、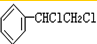 +2NaOH +2NaOH
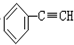 +2NaCl+2H2O +2NaCl+2H2O | |||
D、2CH3OH
|
某元素的+2价阳离子核外共有18个电子,则关于此元素的叙述正确的是( )
| A、原子半径比钾的原子半径大 |
| B、氯化物难溶于水 |
| C、离子半径比氯离子半径大 |
| D、碳酸盐难溶于水 |
下列物质既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的是( )
| A、乙酸乙酯 | B、油酸 |
| C、乙酸 | D、植物油 |
下列反应中,生成物总能量高于反应物总能量的是( )
| A、乙醇燃烧 |
| B、氧化钙溶于水 |
| C、锌粉和稀硫酸反应 |
| D、Ba(OH)2?8H2O和NH4Cl固体反应 |
在下列反应中硫元素只显氧化性的是( )
A、2Al+3S
| ||||
B、S+2H2SO4(浓)
| ||||
C、H2S
| ||||
D、3S+6NaOH
|
下列不属于铵盐的共同性质的是( )
| A、与烧碱反应共热产生氨气 |
| B、都易溶于水 |
| C、受热分解都产生氨气 |
| D、都是晶体 |
某元素原子最外电子层上有2个电子,下列关于该元素叙述正确的是( )
| A、是金属元素 |
| B、是ⅡA族元素 |
| C、其最高价为+2价 |
| D、不能准确判断 |