题目内容
(2013?浙江模拟)某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
(1)用下列实验装置制取干燥纯净的氯气
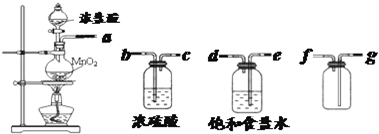
①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为
②该实验还存在不足之处,应如何改进?
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分.探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:
②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空.
由此得出结论:假设
(3)为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Fe(OH)3溶解度小于Mg(OH)2溶解度
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
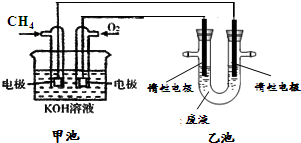
(4)a溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是
(1)用下列实验装置制取干燥纯净的氯气

①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为
a、e、d、b、c、g、f
a、e、d、b、c、g、f
(填仪器接口的字母编号)②该实验还存在不足之处,应如何改进?
装置的最后需要连接装有氢氧化钠溶液的尾气吸收装置
装置的最后需要连接装有氢氧化钠溶液的尾气吸收装置
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分.探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②:
FeCl2
FeCl2
;假设③:FeCl3 和FeCl2 混合物
FeCl3 和FeCl2 混合物
.②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空.
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液色 不褪色 |
固体物质中不含______ |
①
①
成立(填序号①②③).(3)为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是
AD
AD
(填写序号)A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明Fe(OH)3溶解度小于Mg(OH)2溶解度
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe2O3固体
(4)a溶液常作印刷电路铜板的腐蚀剂,得到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是
CH4+10OH--8e-=CO32-+7H2O
CH4+10OH--8e-=CO32-+7H2O
,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为1.12L
1.12L
(假设气体全部逸出).
分析:(1)①制备并收集得到干燥纯净的氯气,氯气中含有氯化氢和水蒸气,需要通过洗气瓶除去,先用饱和食盐水除去氯化氢,再通过浓硫酸吸收水蒸气得到干燥氯气,洗气装置导气管是长进短出;收集气体需要用向上排气法收集,导气管长进短出;
(2)①根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
②固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
(3)a通过实验验证为FeCL3
A、依据沉淀转化原理是向更难溶的方向进行;
B、铁和三价铁之间反应生成亚铁离子;
C、沸水中氯化铁水解生成氢氧化铁胶体;
D、溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀;
(4)甲池是甲烷燃料电池,燃料失电子在负极发生氧化反应,乙池为电解池,依据电路中电子守恒结合电极反应计算;
(2)①根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或二者的混合物;
②固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质;
(3)a通过实验验证为FeCL3
A、依据沉淀转化原理是向更难溶的方向进行;
B、铁和三价铁之间反应生成亚铁离子;
C、沸水中氯化铁水解生成氢氧化铁胶体;
D、溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀;
(4)甲池是甲烷燃料电池,燃料失电子在负极发生氧化反应,乙池为电解池,依据电路中电子守恒结合电极反应计算;
解答:解:(1)①制备并收集得到干燥纯净的氯气,氯气中含有氯化氢和水蒸气,需要通过洗气瓶除去,先用饱和食盐水除去氯化氢,再通过浓硫酸吸收水蒸气得到干燥氯气,洗气装置导气管是长进短出;收集气体需要用向上排气法收集,导气管长进短出;连接顺序是a、e、d、b、c、g、f;故答案为:a、e、d、b、c、g、f;
②氯气有毒污染空气,需要在装置的最后连接装有氢氧化钠溶液的尾气吸收装置;
故答案为:装置的最后需要连接装有氢氧化钠溶液的尾气吸收装置;
(2)①根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl3;FeCl3和FeCl2;
②固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2;证明假设①正确;
故答案为:溶液变红色;FeCl2;①;
(3)a通过实验验证为FeCl3
A、向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,依据沉淀转化原理,反应向更难溶的分析进行,证明Fe(OH)3溶解度小于Mg(OH)2溶解度;故A正确;
B、铁和三价铁之间反应生成亚铁离子,溶液颜色变化为黄色变化为浅绿色;故B错误;
C、三价铁在沸水中水解生成氢氧化铁胶体,故C错误;
D、溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀,灼烧得到Fe2O3固体,故D正确;
故答案为:AD.
(4)通入甲烷的一端为原电池的负极失电子发生氧化反应,电极反应为:CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,得到的废液中提炼金属铜,阴极电极反应为:
Cu2++2e-=Cu,当阴极增重3.2g是铜物质的量为0.05mol,电子转移为0.1mol,停止通电,阳极电极反应氯离子失电子生成氯气,电极反应2Cl--2e-=Cl2↑,此时阳极产生气体的体积为0.05mol,标准状况下体积=0.05mol×22.4L/mol=1.12L;
故答案为:CH4+10OH--8e-=CO32-+7H2O,1.12L;
②氯气有毒污染空气,需要在装置的最后连接装有氢氧化钠溶液的尾气吸收装置;
故答案为:装置的最后需要连接装有氢氧化钠溶液的尾气吸收装置;
(2)①根据类比法,结合铁和硝酸反应的产物,产物可能为FeCl2、FeCl3或FeCl3和FeCl2的混合物,
故答案为:FeCl3;FeCl3和FeCl2;
②固体物质中有FeCl3,在溶液中加入KSCN溶液,溶液应变红,在酸性KMnO4溶液中加入少量A,KMnO4溶液颜色无明显变化,说明不变含还原性物质,即不含FeCl2;证明假设①正确;
故答案为:溶液变红色;FeCl2;①;
(3)a通过实验验证为FeCl3
A、向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,依据沉淀转化原理,反应向更难溶的分析进行,证明Fe(OH)3溶解度小于Mg(OH)2溶解度;故A正确;
B、铁和三价铁之间反应生成亚铁离子,溶液颜色变化为黄色变化为浅绿色;故B错误;
C、三价铁在沸水中水解生成氢氧化铁胶体,故C错误;
D、溶液加热蒸干,水解生成的氯化氢挥发,三价铁离子易水解生成红褐色沉淀,灼烧得到Fe2O3固体,故D正确;
故答案为:AD.
(4)通入甲烷的一端为原电池的负极失电子发生氧化反应,电极反应为:CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,得到的废液中提炼金属铜,阴极电极反应为:
Cu2++2e-=Cu,当阴极增重3.2g是铜物质的量为0.05mol,电子转移为0.1mol,停止通电,阳极电极反应氯离子失电子生成氯气,电极反应2Cl--2e-=Cl2↑,此时阳极产生气体的体积为0.05mol,标准状况下体积=0.05mol×22.4L/mol=1.12L;
故答案为:CH4+10OH--8e-=CO32-+7H2O,1.12L;
点评:本题考查了氯气实验室制备和气体净化实验方法,物质检验实验设计和试剂选择,原电池电极反应和电解原理的应用和计算,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
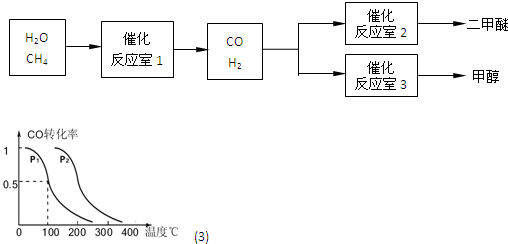
 CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将
CO(g)+3H2(g)△H>0.在其它条件不变的情况下降低温度,逆反应速率将 CH3OCH3+H2O
CH3OCH3+H2O CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则: CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为