题目内容
(1)甲烷是一重要的清洁能源、请写出以KOH溶液为电解质溶液,甲烷燃料电池的正极反应式: 。
(2)电解原理在化学工业中有广泛的应用。图中a为电解液,X和Y是两块电极板,则:

①若X和Y分别为铁和石墨,a为饱和食盐水,则电解时X电极反应式为 。
②若X、Y分别为石墨和铁,a为饱和食盐水,则电解过程中生成的白色固体露置在空气中,可观察到的现象是 。
(3)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。电解完毕后,某兴趣小组欲对电解溶中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线如下图。

①结合右图分析,相同温度下Kap[Cu(OH)2]、Kap[Ni(OH)2]、Kap[Fe(OH)2]由大到小的顺序为 。
②分离过程中,使上述溶液的pH逐渐增加,则溶液中的Cu2+、Fe2+和Ni2+沉淀的先后顺序依次为 (填写离子符号)。
(共10分,每空2分)
(1)O2+2H2O+4e-=4OH-
(2)①2H++2e-=H2↑
②白色固体迅速变灰绿色,最终变成红褐色。
(3)①Kap[Fe(OH)2]>Kap[Ni(OH)2]>Kap[Cu(OH)2]
②Fe3+、Cu2+、Fe2+

练习册系列答案
相关题目
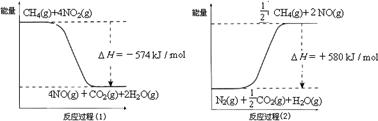


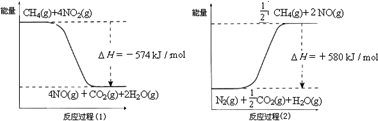
 (2)电解原理在化学工业中有广泛的应用。图中a为电解液,X
(2)电解原理在化学工业中有广泛的应用。图中a为电解液,X