题目内容
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:CO2+H2(g)  CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | | 0.40 |
| t2 | 0.90 | |
下列说法不正确的是
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平衡时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L
BD
解析试题分析:A、v(H2O)=v(H2)=(1.00-0.4)÷1÷t1="0.60" /t1 mol·L-1·min-1,正确;B、根据t1和t2时反应物的量确定反应已达到平衡,
CO2+H2(g)  CO(g)+H2O(g)
CO(g)+H2O(g)
始量 1.50 1.00
转化量0.60 0.60 0.60 0.60
平衡量0.90 0.40 0.60 0.60
k= 0.60×0.60÷(0.90×0.40)=1.00
升高温度,k变大,平衡向正向进行,正反应为吸热反应,错误 ;
C、两种反应物增加一种反应物的浓度,可提高另一种反应物的转化率,正确;D、两者不是等效平衡,错误。
考点:考查化学平衡有关问题。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案Fenton试剂常用于氧化降解有机污染物X。在一定条件下.反应初始时c(X)=2.0×10-3 mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是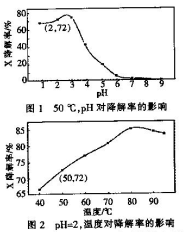
| A.50oC,PH在3~6之间,X降解率随PH增大而减小 |
| B.PH=2,温度在40~80 oC,X降解率温度升高而增大 |
| C.无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80 oC |
| D.PH=2、温度为50oC,10min内v(X)=1.44x10-4 mol·L-1min-1 |
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
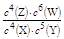
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
| A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
| B.其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2 |
| C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大 |
| D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 |
可逆反应aA(g) + bB(g) 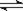 cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是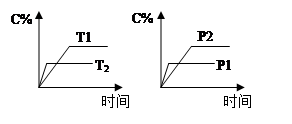
| A.达平衡后,若升温,平衡左移 |
| B.达平衡后,加入催化剂则C%增大 |
| C.化学方程式中a+b>c+d |
| D.达平衡后,减少A的量有利于平衡向右移动 |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.Ksp(AgCl)>Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)=AgI(s)+ Cl-(aq)能够发生 |
| D.Ka(HCN)<Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)??2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )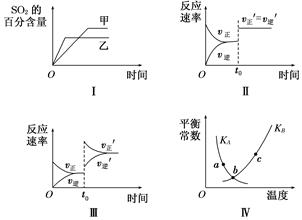
| A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
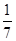
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
 2C(g)达到平衡状态标志的是( )。
2C(g)达到平衡状态标志的是( )。