��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣��������е���ĸ�ֱ����һ�ֻ�ѧԪ�أ� 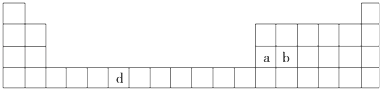
��1����д��Ԫ��d�Ļ�̬ԭ�ӵ����Ų�ʽ ��
��2��bԪ�ص���������b����Ԫ��֮��Ĺ��ۼ������� �� ����bԭ�ӵ��ӻ���ʽ�� ��
��3��a���ʾ�����ԭ�ӵĶѻ���ʽ����ͼ����ʾ���侧����������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ����ͼ����ʾ�� 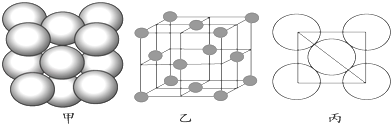
����֪a��ԭ�Ӱ뾶Ϊd��NA���������ӵ�������a�����ԭ������ΪM����һ��������aԭ�ӵ���ĿΪ �� �þ�����ܶ�Ϊ������ĸ��ʾ����
���𰸡�
��1��1s22s22p63s23p63d54s1
��2�����Թ��ۼ���sp3
��3��4��![]()
���������⣺��Ԫ�������ڱ��е�λ�ÿ�֪��aΪAl��bΪSi��dΪCr����1��CrΪ24Ԫ�أ�������24�����ӣ����ݺ��ع����������d��������ʱ���ȶ���������Ų�ʽ��1s22s22p63s23p63d54s1 �� ���Դ��ǣ�1s22s22p63s23p63d54s1����2��SiO2������Si��O��Si��O�Լ��ϵ�����������ͬ��Ϊ���Թ��ۼ���������Siԭ�ӳ�4��Si��O�����ӻ������ĿΪ4��Si���ӻ���ʽ��sp3�ӻ��� ���Դ��ǣ����Թ��ۼ���sp3����3��������Alԭ����ĿΪ��8�� ![]() +6��
+6�� ![]() =4���þ���������m=4��
=4���þ���������m=4�� ![]() ���þ��������V=��4��d��
���þ��������V=��4��d�� ![]() ��3=16
��3=16 ![]() d3 �� �����ܶȦ�=
d3 �� �����ܶȦ�= ![]() =
= ![]() =
= ![]() �����Դ��ǣ�4��
�����Դ��ǣ�4�� ![]() ��
��

����Ŀ�������£���ijһԪ��HA��NaOH��Һ�������ϣ�������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±�����ش�
ʵ���� | HA���ʵ���Ũ�� | NaOH���ʵ���Ũ�� | �����Һ��pH |
�� | 0.2 | 0.2 | pH=a |
�� | c | 0.2 | pH=7 |
�� | 0.2 | 0.1 | pH��7 |
�� | 0.1 | 0.1 | pH=9 |
��1���������������ʵ���������Ӽ�����������������a �������Һ��pH����˵��HA��ǿ�ỹ������ ��
��2���������������ʵ�����������������������C�Ƿ�һ������0.2��ѡ��ǡ��������Һ������Ũ��c��A������ c��Na+���Ĵ�С��ϵ�� ��
��3������ʵ����������HA���ᣨѡ�ǿ�������������û����Һ������Ũ���ɴ�С��˳���� ��
��4������ʵ�����û����Һ����ˮ�������c��OH����=molL��1 �� д���û����Һ��������ʽ�ľ�ȷ��������������Ƽ��㣩��c��Na+����c��A����=molL��1 c��OH������c��HA��=molL��1 ��