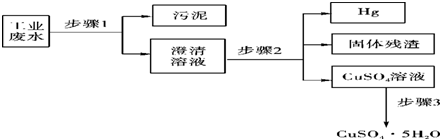
题目内容
 某工业废水中含有Ba2+,Cu2+,Ag+,选择合适试剂,将这三种离子逐一沉淀分离.其流程图如下:
某工业废水中含有Ba2+,Cu2+,Ag+,选择合适试剂,将这三种离子逐一沉淀分离.其流程图如下:
(1)沉淀1的化学式为______,
(2)写出混合液+A的离子方程式______
(3)若C为Na2S,且它与B属于同一类盐,则B试剂的名称是______
| Ba2+ | Cu2+ | Ag+ | |
| Cl- | 溶 | 溶 | 不 |
| CO32- | 不 | 不 | 不 |
| SO42- | 不 | 溶 | 不 |
| S2- | 溶 | 不 | 不 |
解:沉淀Ag+应加入Cl-,沉淀Ba2+应加入SO42-,沉淀Cu2+应加入S2-,注意将这三种离子逐一进行沉淀分离的要求,即每次加入的物质应生成一种沉淀,如加入CO32-,则三种金属离子都生成碳酸盐沉淀,如先加入SO42-,则会同时生成硫酸钡和硫酸银沉淀,如先加入S2-,则会同时生成硫化银、硫化铜沉淀,
所以阴离子加入的顺序应为Cl-、SO42-、S2-,
(1)先加入Cl-,首先生成AgCl,故答案为:AgCl;
(2)先加入Cl-,与混合液反应的离子方程式为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(3)加入的B为硫酸盐,加入的C为Na2S,二者属于同一类盐,即都为钠盐,则B试剂为硫酸钠溶液,故答案为:硫酸钠溶液.
分析:由题意可知,沉淀Ag+应加入Cl-,沉淀Ba2+应加入SO42-,沉淀Cu2+应加入S2-,注意将这三种离子逐一进行沉淀分离的要求,即每次加入的物质应生成一种沉淀,如加入CO32-,则三种金属离子都生成碳酸盐沉淀,如先加入SO42-,则会同时生成硫酸钡和硫酸银沉淀,如先加入S2-,则会同时生成硫化银、硫化铜沉淀.
点评:本题考查物质的分离和提纯的实验方案的设计,题目难度中等,注意结合表中数据判断物质的性质,以选择合适的处理方法.
所以阴离子加入的顺序应为Cl-、SO42-、S2-,
(1)先加入Cl-,首先生成AgCl,故答案为:AgCl;
(2)先加入Cl-,与混合液反应的离子方程式为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(3)加入的B为硫酸盐,加入的C为Na2S,二者属于同一类盐,即都为钠盐,则B试剂为硫酸钠溶液,故答案为:硫酸钠溶液.
分析:由题意可知,沉淀Ag+应加入Cl-,沉淀Ba2+应加入SO42-,沉淀Cu2+应加入S2-,注意将这三种离子逐一进行沉淀分离的要求,即每次加入的物质应生成一种沉淀,如加入CO32-,则三种金属离子都生成碳酸盐沉淀,如先加入SO42-,则会同时生成硫酸钡和硫酸银沉淀,如先加入S2-,则会同时生成硫化银、硫化铜沉淀.
点评:本题考查物质的分离和提纯的实验方案的设计,题目难度中等,注意结合表中数据判断物质的性质,以选择合适的处理方法.

练习册系列答案
相关题目