题目内容
(1)1mol H2SO3中含______mol硫原子,______个氧原子;物质的量相等的CO和CO2中,分子个数之比为______;原子个数之比为______;氧原子个数之比为______;电子个数之比为______.
(2)有下列物质:①0.5mol NH3 ②标准状况下22.4L He ③4℃时9mL H2O ④0.2mol H3PO4 按所含的原子数由多到少的顺序排列,正确的是______.
解:(1)1mol H2SO3中含有S原子为1mol,氧原子物质的量是H2SO3的3倍,氧原子为1mol×3=3mol,含有氧原子数目为3mol×NAmol-1=3NA;
根据N=nNA可知,物质的量相等CO和CO2含有的分子数目相等,即CO和CO2分子个数之比为1:1,含有的原子数目之比等于分子中含有的原子数目之比为2:3,含有的氧原子之比等于分子含有的氧原子数目之比为1:2,含有的电子之比等于分子含有的电子数目之比为(6+8):(6+8×2)=7:11,
故答案为:1;3NA;1:1;2:3;1:2;7:11;
(2)①氨气分子含有4个原子,原子的物质的量为氨气的4倍,0.5mol氨气含有原子的物质的量为0.5mol×4=2mol;
②氦气的物质的量为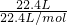 =1mol,氦气是单原子分子,故氦原子的物质的量为1mol;
=1mol,氦气是单原子分子,故氦原子的物质的量为1mol;
③水的质量为9mL×1g/mL=9g,故水的物质的量为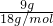 =0.5mol,原子物质的量为水的3倍,故含有原子的物质的量为0.5mol×3=1.5mol;
=0.5mol,原子物质的量为水的3倍,故含有原子的物质的量为0.5mol×3=1.5mol;
④磷酸分子含有8个原子,原子的物质的量为磷酸的8倍,0.2mol磷酸含有原子的物质的量为0.2mol×8=1.6mol;
故含有原子数目由多到少顺序为:①④③②,故答案为:①④③②.
分析:(1)H2SO3中硫原子物质的量等于H2SO3的物质的量,氧原子物质的量是H2SO3的3倍,根据N=nNA计算氧原子数目;
根据N=nNA可知,物质的量相等CO和CO2含有的分子数目相等,含有的原子数目之比等于分子中含有的原子数目之比,含有的氧原子之比等于分子含有的氧原子数目之比,含有的电子之比等于分子含有的电子数目之比;
(2)原子的物质的量越大,含有原子的数目越多,
①氨气分子含有4个原子,原子的物质的量为氨气的4倍;
②根据n=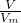 计算氦气的物质的量,氦气是单原子分子,计算氦原子的物质的量;
计算氦气的物质的量,氦气是单原子分子,计算氦原子的物质的量;
③根据m=ρV计算水的质量,根据n= 计算水的物质的量,原子物质的量为水的3倍;
计算水的物质的量,原子物质的量为水的3倍;
④磷酸分子含有8个原子,原子的物质的量为磷酸的8倍.
点评:本题考查物质的量的有关计算,比较基础,注意根据分子进行的原子数目的计算,对公式灵活运用.
根据N=nNA可知,物质的量相等CO和CO2含有的分子数目相等,即CO和CO2分子个数之比为1:1,含有的原子数目之比等于分子中含有的原子数目之比为2:3,含有的氧原子之比等于分子含有的氧原子数目之比为1:2,含有的电子之比等于分子含有的电子数目之比为(6+8):(6+8×2)=7:11,
故答案为:1;3NA;1:1;2:3;1:2;7:11;
(2)①氨气分子含有4个原子,原子的物质的量为氨气的4倍,0.5mol氨气含有原子的物质的量为0.5mol×4=2mol;
②氦气的物质的量为
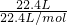 =1mol,氦气是单原子分子,故氦原子的物质的量为1mol;
=1mol,氦气是单原子分子,故氦原子的物质的量为1mol;③水的质量为9mL×1g/mL=9g,故水的物质的量为
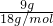 =0.5mol,原子物质的量为水的3倍,故含有原子的物质的量为0.5mol×3=1.5mol;
=0.5mol,原子物质的量为水的3倍,故含有原子的物质的量为0.5mol×3=1.5mol;④磷酸分子含有8个原子,原子的物质的量为磷酸的8倍,0.2mol磷酸含有原子的物质的量为0.2mol×8=1.6mol;
故含有原子数目由多到少顺序为:①④③②,故答案为:①④③②.
分析:(1)H2SO3中硫原子物质的量等于H2SO3的物质的量,氧原子物质的量是H2SO3的3倍,根据N=nNA计算氧原子数目;
根据N=nNA可知,物质的量相等CO和CO2含有的分子数目相等,含有的原子数目之比等于分子中含有的原子数目之比,含有的氧原子之比等于分子含有的氧原子数目之比,含有的电子之比等于分子含有的电子数目之比;
(2)原子的物质的量越大,含有原子的数目越多,
①氨气分子含有4个原子,原子的物质的量为氨气的4倍;
②根据n=
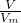 计算氦气的物质的量,氦气是单原子分子,计算氦原子的物质的量;
计算氦气的物质的量,氦气是单原子分子,计算氦原子的物质的量;③根据m=ρV计算水的质量,根据n=
 计算水的物质的量,原子物质的量为水的3倍;
计算水的物质的量,原子物质的量为水的3倍;④磷酸分子含有8个原子,原子的物质的量为磷酸的8倍.
点评:本题考查物质的量的有关计算,比较基础,注意根据分子进行的原子数目的计算,对公式灵活运用.

练习册系列答案
相关题目
 某烷烃的结构简式如图.
某烷烃的结构简式如图.