题目内容
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

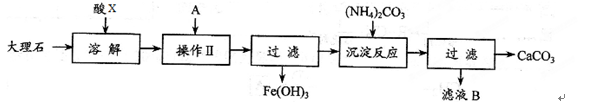
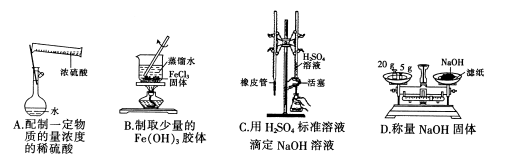
(1)已知滤液B的主要成份是硝酸铵,则酸X为_______(填名称,下同),A物质为_______。
(2) 检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
(3) 写出加入碳酸铵所发生反应的离子方程式: 。
写出加入碳酸铵所发生反应的离子方程式: 。
(4) CaO2可作供氧剂,写出CaO2与水反应的化学方程式:____________。
(5)CaO2中一般含CaO,某探究小组按下列过程测量CaO2含量:首先称取0.80g样品,然后将样品溶于100mL 1.0mol/L的盐酸中,收集到的气体在标准状况下的体积为112mL,则该样品中CaO2含量为___________。
(6)要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为______mL;配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有______________。


(1)已知滤液B的主要成份是硝酸铵,则酸X为_______(填名称,下同),A物质为_______。
(2)
 检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。(3)
 写出加入碳酸铵所发生反应的离子方程式: 。
写出加入碳酸铵所发生反应的离子方程式: 。(4) CaO2可作供氧剂,写出CaO2与水反应的化学方程式:____________。
(5)CaO2中一般含CaO,某探究小组按下列过程测量CaO2含量:首先称取0.80g样品,然后将样品溶于100mL 1.0mol/L的盐酸中,收集到的气体在标准状况下的体积为112mL,则该样品中CaO2含量为___________。
(6)要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为______mL;配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有______________。
(1)硝酸;氨水 (2)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+。
(3)Ca2++CO32-=CaCO3↓ (4)CaO2+2H2O=Ca(OH)2+O2↑
(5)45% (6)8.0;100ml容量瓶、玻璃棒
(3)Ca2++CO32-=CaCO3↓ (4)CaO2+2H2O=Ca(OH)2+O2↑
(5)45% (6)8.0;100ml容量瓶、玻璃棒
试题分析:(1)已知滤液B的主要成份是硝酸铵,则根据原子守恒可知酸X为硝酸。溶液中含有铁离子,要转化为氢氧化铁沉淀,则需要加入碱液。根据滤液B是硝酸铵可知,A应该是氨水。
(2)三价铁离子遇到硫氰酸根离子会呈现红色,方程式为Fe3++3SCN-=Fe(SCN)3,据此可以检验铁离子的存在。即取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+。
(3)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应的离子方程式为Ca2++CO32-=CaCO3↓。
(4)过氧化钙的性质类似于过氧化钠,与水反应的化学方程式为CaO2+2H2O=Ca(OH)2+O2↑。
(5)氧化钙与水反应得不到气体,只有过氧化钙与水反应生成氧气,其中氧气的物质的量=0.112L÷22.4L/mol=0.005mol。则根据方程式CaO2+2H2O=Ca(OH)2+O2↑可知消耗过氧化钙的物质的量是0.005mol,质量=0.005mol×72g/mol=0.36g,所以该样品中CaO2含量为
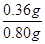 ×100%=45%。
×100%=45%。(6)在稀释过程中溶质是不变的,则要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为
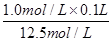 =0.008L=8.0ml。配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有100ml容量瓶、玻璃棒。
=0.008L=8.0ml。配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有100ml容量瓶、玻璃棒。
练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目