题目内容
向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是

A.M点对应的溶液中:K+、Fe2+、NO3-、SO42-
B.N点对应的溶液中:K+、NH4+、HCO3-、Cl﹣
C.S点对应的溶液中:Na+、Ag+、SO42- 、NO3-
、NO3-
D.R点对应的溶液中:Na+、SO42-、NO3-、Cl﹣
练习册系列答案
相关题目
14.2015年8月12日,天津港大爆炸造成巨量危险化学品NaCN(氰化钠)的部分泄露.泄露的NaCN可用双氧水处理,其反应为:NaCN+H2O2+H2O=NaHCO3+NH3,下列有关说法不正确的是( )
| A. | NaCN中碳元素化合价为+2价 | |
| B. | H2O2在该反应中做还原剂 | |
| C. | NaCN中含有离子键和极性共价键 | |
| D. | 生成0.1 mol NH3时,有0.2 mol电子转移 |
15. 25℃时,向20.00mLNaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴加过程中,溶液的PH与滴入CH3COOH溶液的体积关系如图所示,点 ②时NaOH溶液恰好被中和.则下列说法正确的是( )
25℃时,向20.00mLNaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴加过程中,溶液的PH与滴入CH3COOH溶液的体积关系如图所示,点 ②时NaOH溶液恰好被中和.则下列说法正确的是( )
 25℃时,向20.00mLNaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴加过程中,溶液的PH与滴入CH3COOH溶液的体积关系如图所示,点 ②时NaOH溶液恰好被中和.则下列说法正确的是( )
25℃时,向20.00mLNaOH溶液中逐滴加入某浓度的CH3COOH溶液.滴加过程中,溶液的PH与滴入CH3COOH溶液的体积关系如图所示,点 ②时NaOH溶液恰好被中和.则下列说法正确的是( )| A. | 点 ①②之间一定为c(Na+)>c(CH3COOO-)>c(OH-)>c(H+) | |
| B. | 点 ③处有c(Na+)=c(CH3COOO-)+c(CH3COOH) | |
| C. | 点①②③④处水的电离程度由大到小的顺序额为 ②③④① | |
| D. | 点④处有c(H+)+c(CH3COOH)=2c(OH-)-c(CH3COOO-) |
将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
操作 | 现象 | |
A | 加入NaOH溶液 | 有红褐色沉淀 |
B | 加入Ba(NO3)2溶液 | 有白色沉淀 |
C | 加入酸性KMnO4溶液 | 紫色褪去 |
D | 加入K3[Fe(CN)6](铁氰化钾)溶液 | 有蓝色沉淀 |




 +3Br2→
+3Br2→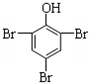 ↓+3HBr;反应类型取代反应.
↓+3HBr;反应类型取代反应. ;反应类型取代反应.
;反应类型取代反应. ;反应类型加聚反应.
;反应类型加聚反应.