题目内容
常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示.则下列叙述中正确的是( )
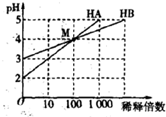
| A.HA是一种弱酸 |
| B.稀释前,c(HA)=10c(HB) |
| C.在M点的两种溶液中:c(B-)=c(A-),且c(B-)+c(H+)>c(A-)+c(OH-) |
| D.在NaB和HB的混合溶液中一定存在:c(B-)>c(Na+)>c(H+)>c(OH-) |

A.HA开始的pH=2,稀释100倍pH=4,则HA为强酸,故A错误;
B.HA为强酸,HB为弱酸,稀释前,c(HA)=0.01mol/L,c(HB)>0.001mol/L,则c(HA)<10c(HB),故B错误;
C.M点pH=4,则c(H+)>c(OH-),如c(B-)=c(A-),则c(B-)+c(H+)>c(A-)+c(OH-),故C正确;
D.NaB和HB的混合溶液中,因B-的水解程度和HB电离程度未知,则溶液的酸碱性不能确定,故D错误.
故选C.
B.HA为强酸,HB为弱酸,稀释前,c(HA)=0.01mol/L,c(HB)>0.001mol/L,则c(HA)<10c(HB),故B错误;
C.M点pH=4,则c(H+)>c(OH-),如c(B-)=c(A-),则c(B-)+c(H+)>c(A-)+c(OH-),故C正确;
D.NaB和HB的混合溶液中,因B-的水解程度和HB电离程度未知,则溶液的酸碱性不能确定,故D错误.
故选C.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目

 的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性
的CH3COOH溶液与c mol/LCH3COONa溶液等体积混合溶液显碱性 液中不断滴加氢氧化钠溶液,若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0
液中不断滴加氢氧化钠溶液,若c(CH3COO-) >c(Na+) >c(H+)> c(OH-)则δ1一定大于δ0 cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42-)=c
cmol/L的H2C2O4(草酸)溶液中,一定满足c(H2C2O4)+ c(C2O42-)=c