题目内容
I、(10分)现有下列电解质溶液:① Na 2CO3 ② NaHCO3 ③苯酚钠(不与碱反应) ④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3 > 苯酚> HCO3-。常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH 7(填>、=或<), 理由是:
II、(4分)室温时,向a mL 0.10 mol/L的稀氨水中逐滴加入 b mL 0.10 mol/L的稀盐酸,试分析:
(1)当b=a时,溶液呈________(填“酸”“碱”或“中”)性,此时溶液中,c(NH)________(填“>”“<”或“=”)c(Cl-).
(2)当溶液呈中性时,a________(填“>”“<”或“=”)b,此时溶液中c(NH)________c(Cl-)(同上).
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号):
(2)已知:酸性H2CO3 > 苯酚> HCO3-。常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为(填写序号):
(3)写出⑤与足量NaOH溶液混合加热反应的离子方程式
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH 7(填>、=或<), 理由是:
II、(4分)室温时,向a mL 0.10 mol/L的稀氨水中逐滴加入 b mL 0.10 mol/L的稀盐酸,试分析:
(1)当b=a时,溶液呈________(填“酸”“碱”或“中”)性,此时溶液中,c(NH)________(填“>”“<”或“=”)c(Cl-).
(2)当溶液呈中性时,a________(填“>”“<”或“=”)b,此时溶液中c(NH)________c(Cl-)(同上).
(14分)Ⅰ(10分)答案:(1)②④⑤ (2分)(漏选给1分,错选不给分)
(2)①>③>② (2分) (3)2OH-+HCO3-+NH4+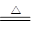 CO32-+2H2O+NH3↑(2分)
CO32-+2H2O+NH3↑(2分)
(4) > (2分) 由题知,醋酸的酸性与NH3.H2O的碱性强弱相当,而碳酸酸性比醋酸弱,即碳酸的酸性比NH3.H2O的碱性弱,故NH4HCO3溶液显碱性(2分)
Ⅱ(共4分,每空1分)18、 (1) 酸 < (2) > =
(2)①>③>② (2分) (3)2OH-+HCO3-+NH4+
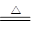 CO32-+2H2O+NH3↑(2分)
CO32-+2H2O+NH3↑(2分)(4) > (2分) 由题知,醋酸的酸性与NH3.H2O的碱性强弱相当,而碳酸酸性比醋酸弱,即碳酸的酸性比NH3.H2O的碱性弱,故NH4HCO3溶液显碱性(2分)
Ⅱ(共4分,每空1分)18、 (1) 酸 < (2) > =
试题分析:Ⅰ(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是②④⑤。
(2)酸越弱,相应的钠盐越容易水解,则根据酸性强弱顺序可知,常温下,物质的量浓度相同的① 、②、 ③溶液pH大小顺序为①>③>②。
(3)碳酸氢铵与足量NaOH溶液混合加热反应的离子方程式是2OH-+HCO3-+NH4+
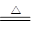 CO32-+2H2O+NH3↑。
CO32-+2H2O+NH3↑。(4)常温下CH3COONH4溶液呈中性,这说明醋酸的酸性与NH3.H2O的碱性强弱相当,而碳酸酸性比醋酸弱,即碳酸的酸性比NH3.H2O的碱性弱,故NH4HCO3溶液显碱性。
II、(1)a=b,说明二者恰好反应生成氯化铵,氯化铵水解,溶液显酸性。根据电荷守恒可知c(NH)+c(H+)=c(OH-)+c(Cl-),所以c(NH)<c(Cl-)。
(2)当溶液呈中性时,说明氨水过量,因此a>b。根据电荷守恒可知c(NH)+c(H+)=c(OH-)+c(Cl-),所以c(NH)=c(Cl-)。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和学习方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生的应试能力。该题的关键是利用好溶液中的几种守恒关系,即电荷守恒、物料守恒和质子守恒。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 +HSO4-==CO2↑+H2O+SO42—
+HSO4-==CO2↑+H2O+SO42— +CO2+H2O===2HCO
+CO2+H2O===2HCO