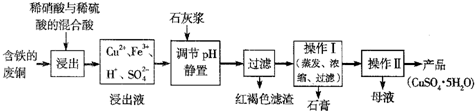
题目内容
在实验室利用胆矾晶体和烧碱溶液,经下列步骤制备氧化铜固体:①溶解胆矾②滴加烧碱溶液③过滤④灼烧滤渣。请填空:
(1)在实验中多次用到玻璃棒,其作用有三个,分别是
(2)氢氧化铜微热即分解,其化学反应方程式是 。
(3)乙同学改进了上述实验步骤,即把先过滤后灼烧改为先加热浑浊液后过滤。其优点是:
(1)搅拌 引流 转移
(2)Cu(OH)2==CuO+H2O
(3)缩短过滤的时间。

练习册系列答案
 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案
相关题目