题目内容
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A:4HCl+O2
2Cl2+2H2O,可实现氯的循环利用.
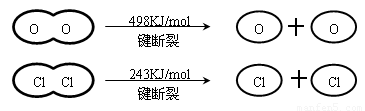
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.
Ⅱ.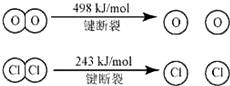
则断开1mol H-O键与断开1mol H-Cl键所需能量相差约为( )
| ||
| 400℃ |
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.
Ⅱ.

则断开1mol H-O键与断开1mol H-Cl键所需能量相差约为( )
| A、16kJ | B、24kJ |
| C、32kJ | D、48kJ |
分析:反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差.
解答:解:E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,
反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:
4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,
整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,
故选C.
反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:
4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,
整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,
故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,
故选C.
点评:本题考查反应热的有关计算,难度不大,注意掌握键能与焓变关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.400℃,催化剂作用下,反应A:4HCl+O2═2Cl2+2H2O
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.400℃,催化剂作用下,反应A:4HCl+O2═2Cl2+2H2O

 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
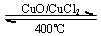 2Cl2+2H2O
2Cl2+2H2O