题目内容
【题目】下列物质:①Ar ②Na2O2 ③CCl4 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是__,不存在化学键的是__,离子化合物有__。
(2)由离子键和极性键构成的物质是__。
(3)N2的电子式为__,HClO的电子式为__,NH4Cl的电子式为__。
(4)用电子式表示MgF2的形成过程__。
【答案】③④⑤ ① ②⑥⑦ ⑦ ![]()
![]()
![]()
【解析】
①Ar中不含化学键;
②Na2O2为离子化合物,由钠离子和过氧根离子构成,其含有离子键和非极性共价键;
③CCl4为共价化合物,其含有极性共价键;
④HClO为共价化合物,其含有极性共价键;
⑤N2中含有非极性共价键;
⑥MgF2为离子化合物,由镁离子、氟离子构成,其含有离子键;
⑦NH4Cl为离子化合物,由铵根离子和氯离子构成,其含有极性共价键和离子键。
(1)综上分析,③④⑤只存在共价键,①Ar不存在化学键,②⑥⑦为离子化合物,故答案为:③④⑤;①;②⑥⑦;
(2)NH4Cl为离子化合物,由铵根离子和氯离子构成,铵根离子中含有极性共价键,铵根离子和氯离子间为离子键,则由离子键和极性键构成的物质是⑦NH4Cl,故答案为:⑦;
(3)N2分子中氮原子之间为氮氮三键,其电子式为![]() ;HClO中H原子与O原子共用一对电子,O原子与Cl原子共用一对电子,电子式为
;HClO中H原子与O原子共用一对电子,O原子与Cl原子共用一对电子,电子式为![]() ;NH4Cl由铵根离子和氯离子构成,其电子式为
;NH4Cl由铵根离子和氯离子构成,其电子式为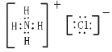 ,故答案为:
,故答案为:![]() ;
;![]() ;
;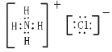 ;
;
(4)氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为![]() ,故答案为:
,故答案为:![]() 。
。

【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】下列实验操作、现象和所得结论错误的是 ( )
选项 | 操作 | 现象 | 结论 |
A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
B | 向久置的Na2SO3溶液中加入足量Ba(NO3)2溶液,再加入足量稀盐酸 | 先出现白色沉淀,然后部分沉淀溶解 | 部分Na2SO3被氧化 |
C | 某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有Fe2+,可能有Fe3+ |
D | 向等浓度的KCl、KI混合液中逐滴滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
A. AB. BC. CD. D
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
HCHO(g)+H2(g) ΔH1=+85.2kJ/mol
反应II:CH3OH(g)+![]() O2(g)
O2(g)![]() HCHO(g)+H2O(g) ΔH2
HCHO(g)+H2O(g) ΔH2
反应III:2H2(g)+O2(g)![]() 2H2O(g) ΔH3=—483.6kJ/mol
2H2O(g) ΔH3=—483.6kJ/mol
(1)计算反应Ⅱ的反应热ΔH2=__________________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即υ正=k正·c(Mb)·P(O2),υ逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=_______。
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=_______(用含有k正、k逆的式子表示)。
II.CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g)![]() CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=
CH2=CH2(g) + 4H2O(g) ΔH=QkJ/mol。一定条件下, 按不同的投料比X[X=![]() ]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
]向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1______X2(填“>”或“<”,后同),Q______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3和NaHCO3。
①已知25℃时0.1mol / L的NaHCO3溶液的pH=8.3,试通过计算确定溶液中各离子浓度由大到小的顺序为_____[已知:常温下H2CO3的电离常数Ka1= 4.4×107、Ka2 = 5×1011 ]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。
[已知:常温下Ksp(BaSO4)=1×107、Ksp(BaCO3)=2.5×106 ]。(忽略溶液体积的变化)