题目内容
【题目】(多选)某小组为研究电化学原理,设计如下图装置,下列叙述中正确的是( ) 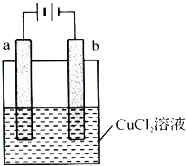
A.若a和b为石墨,通电后a电极上发生的及应为2Cl﹣﹣2e﹣═Cl2↑
B.若a和b为石墨,通电后b电极上发生氧化反应
C.若a为铜,b为铁,通电后a电极质量增加
D.若a为铜,b为铁,通电后 ![]() 向铁电极移动
向铁电极移动
【答案】AD
【解析】解:A、若a和b为石墨,通电后a电极是阳极,该极上发生的反应为2Cl﹣﹣2e﹣═Cl2↑,故A正确;B、在电解池的阴极b极上阳离子得电子发生还原反应,故B错误;
C、电解池的阳极Cu是活泼电极时,该极上电极本身发生失电子的氧化反应,电极质量减轻,故C错误;
D、电解池中电解质中的阳离子铜离子移向阴极,即向铁电极移动,发生得电子的还原反应,故D正确.
故选:AD.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
(1)真空碳热还原﹣氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJmol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJmol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJmol﹣1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=Q kJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= , T1℃时,该反应的平衡常数K= .
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号).
a.通入一定量的NO b.通入一定量的N2 c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填选项编号).
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的压强不再发生改变
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量保持不变
④若保持与上述反应前3Omin的反应条件不变,起始时NO的浓度为2.50mol/L,则反应达平衡时c(NO)=mol/L.NO的转化率(填“增大”、“减小”或“不变”).
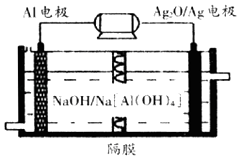
(3)铝电池性能优越,Al﹣Ag2O电池可用作水下动力电源,其原理如图所示
请写出该电池正极反应式;常温下,用该化学电源和惰性电极电解300mL硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的pH=(不考虑溶液体积的变化).