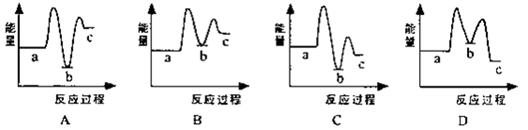
题目内容
在一定温度下的定容密闭容器中,反应:A(s)+2B(g) C(g)+D(g)达到平衡的标志是( )
C(g)+D(g)达到平衡的标志是( )
A.混合气体的压强 B.单位时间生成2n mol的B同时消耗n mol的D
C.混合气体的密度 D.A、B、C、D物质的量之比为1:2:1:1
 C(g)+D(g)达到平衡的标志是( )
C(g)+D(g)达到平衡的标志是( )A.混合气体的压强 B.单位时间生成2n mol的B同时消耗n mol的D
C.混合气体的密度 D.A、B、C、D物质的量之比为1:2:1:1
C
试题分析:达到反应平衡状态时,在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,据此分析解答。
A项:该反应是一个反应前后气体体积不变的化学反应,反应容器中气体的压强一直发生变化,故错;B项:无论该反应是否达到平衡状态,单位时间生成2n mol的B同时消耗n mol的D,故错;D项:物质的物质的量之比不能来判断是否处于平衡状态,故错。故选C。
点评:本题考查化学平衡状态的判断,题目难度不大,本题注意C项为易错点,注意反应前的计量数等于反应后各物质的计量数之和,但反应前后气体的物质的量发生改变。

练习册系列答案
相关题目
 C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。
C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。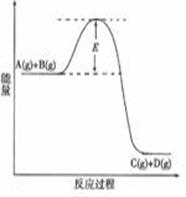
 x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是
x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是 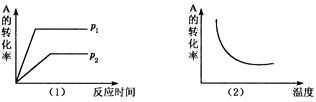
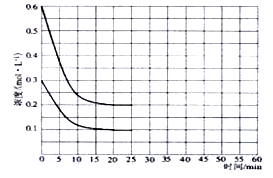
 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。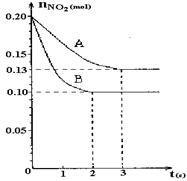

 cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍,下列叙述中不正确的是
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍,下列叙述中不正确的是 xC(g) △H>0,达到化学平衡后,C的体积分数为a。
xC(g) △H>0,达到化学平衡后,C的体积分数为a。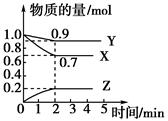
 CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题:
CO(NH2)2(l) + H2O (l) ΔH < 0 。回答下列问题: NH2COONH4(s) ΔH1< 0
NH2COONH4(s) ΔH1< 0 CO(NH2)2(l)+ H2O (l) ΔH 2> 0
CO(NH2)2(l)+ H2O (l) ΔH 2> 0