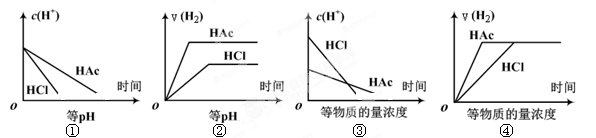
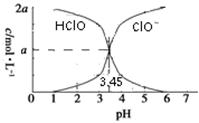
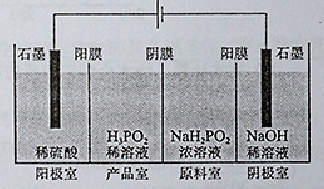
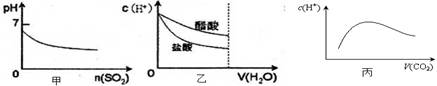
题目内容
常温下,对于0.1 mol.L-1pH= 10的Na2CO3溶液,下列说法正确的是
| A.通入CO2,溶液pH减小 |
B.加入NaOH固体,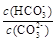 增大 增大 |
| C.由水电离的c(OH-) = 1×10-10 mol.L-1 |
| D.溶液中:c(CO32-)>c(OH-)>c(HCO3-) |
AD
试题分析:CO32-+H2O≒HCO3-+OH-,A.当通入二氧化碳后,二氧化碳与水反应生成碳酸,PH值减小,正确;当加入NaOH固体,水解平衡向逆进行,c(HCO3-)减小,c(CO32-)增大,它们的比值减小,错误;C. pH= 10可计算得到c(H+) = 1×10-10 mol.L-1而c(OH-) = 1×10-4 mol.L-1,这个c(OH-)就是水电离出来的,错误;D.溶液中存在CO32-+H2O≒HCO3-+OH-,H2O≒H++OH-,由于水解相对弱,所以此项正确。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目