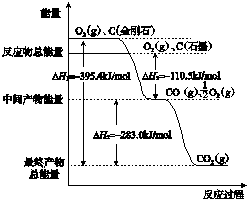
题目内容
7.下列叙述正确的是( )| A. | Na在足量O2中燃烧,消耗1mol O2时转移的电子数是4×6.02×1023 | |
| B. | 标准状况下,6.72L NO2与水分子充分反应转移的电子数目为0.1NA | |
| C. | 盐酸和醋酸的混合溶液pH=1,该溶液中c(H+)=0.1 mol/L | |
| D. | 1 L 0.1 mol/L NH4Cl溶液中的NH4+数是0.1×6.02×1023 |
分析 A、根据反应后氧元素的价态为-1价来分析;
B、0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮;
C、混合溶液pH=1,pH=-lgC(H+);
D、NH4+是弱碱阳离子,在溶液中会水解.
解答 解:A、反应后氧元素的价态为-1价,故l mol O2时转移的电子数是2×6.02×1023,故A错误;
B、标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故B错误;
C、混合溶液pH=1,pH=-lgC(H+)=1,故C(H+)=10-pH=0.1mol/L,故C正确;
D、LNH4+是弱碱阳离子,在溶液中会水解,故NH4+数小于0.1×6.02×1023,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
2.化学方程式可简明地体现元素及其化合物的性质.已知:
氧化还原反应:
2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3
热分解反应:4NaClO $\frac{\underline{\;\;△\;\;}}{\;}$ 3NaCl+NaClO4;NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+2O2↑
下列说法正确是( )
氧化还原反应:
2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3
热分解反应:4NaClO $\frac{\underline{\;\;△\;\;}}{\;}$ 3NaCl+NaClO4;NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$ NaCl+2O2↑
下列说法正确是( )
| A. | 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 | B. | 还原性(碱性溶液):Fe(OH)2>I2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO>NaClO4 | D. | 酸性(水溶液):H2CO3>HSCN>HCN |
12.由1-丙醇制取 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )
①氧化 ②还原 ③取代 ④加成 ⑤消去 ⑥中和 ⑦缩聚 ⑧酯化.
 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )①氧化 ②还原 ③取代 ④加成 ⑤消去 ⑥中和 ⑦缩聚 ⑧酯化.
| A. | ②④⑥⑦⑧ | B. | ⑤④③①⑧ | C. | ①⑤④③⑧ | D. | ②①⑤③⑥ |
17.下列叙述正确的是( )
| A. | 卤代烃都可发生取代反应 | |
| B. | 由2-氯丙烷制取少量的1,2-丙二醇时,只需要经过取代反应、水解反应 | |
| C. | 实验室制硝基苯时,正确的操作顺序应该是先加入苯,再滴加浓硫酸,最后滴加浓硝酸 | |
| D. | 2-甲基-2-丁烯可以形成顺反异构 |
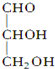
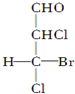

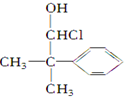

 .
.