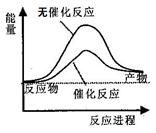
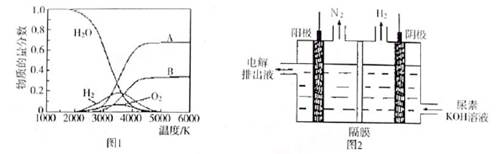
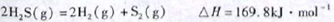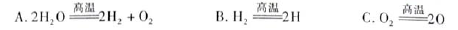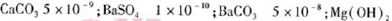题目内容
在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g) 2NH3(g) △H=" —92.4" kJ·mol-1,下列结论正确的是
2NH3(g) △H=" —92.4" kJ·mol-1,下列结论正确的是
 2NH3(g) △H=" —92.4" kJ·mol-1,下列结论正确的是
2NH3(g) △H=" —92.4" kJ·mol-1,下列结论正确的是 | A.该反应达到平衡时,放出的热量等于92.4kJ |
| B.达到平衡后向容器中通入1mol氦气,平衡不移动 |
| C.降低温度和缩小容器体积均可使该反应的平衡常数增大 |
| D.若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
BD
由热化学方程式的意义可知,1mol N2(g)与3mol H2(g)完全反应,生成2mol NH3(g)时放出92.4kJ热量,但是合成氨是可逆反应,正反应不能进行到底,参加反应的物质不能完全消耗,放出的热量小于92.4kJ,故A错误;氦气是惰性气体,不能改变各组分的浓度,虽然能增大压强,但是平衡不能移动,故B正确;正反应是气态物质体积减小的放热反应,则降低温度能使平衡右移,平衡常数增大,而缩小容器体积就是增大压强,虽然平衡也右移,但是平衡常数不变,因为平衡常数只与温度有关,温度不变平衡常数不变,故C错误;起始时容器内气体总量为(1+3)mol=4mol,若氮气减小0.2mol,则氢气减小0.6mol,氨气由0增加为0.4mol,则平衡时含有0.8molN2、2.4molH2、0.4molNH3,则平衡时容器内气体总量为(0.8+2.4+0.4)mol=3.6mol,3.6/4=90%,则平衡时容器内气体总量是起始时容器内气体总量的90%,故D正确。

练习册系列答案
相关题目