题目内容
19.有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用.(1)化合物的化学式:XZHCl,X2YH2O(填化学式).
(2)写出涉及到的3个化学反应方程式.
①Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl
②2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O
③Cl2+H2O=HCl+HClO.
分析 有X、Y、Z三种元素,它们的单质在常温下皆为气体,X单质可在Z单质中燃烧生成XZ,其火焰为苍白色,化合物XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红,说明X单质为H2,Z单质为Cl2,XZ为HCl;每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体,说明Y单质为O2,X2Y为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用,据此解答.
解答 解:有X、Y、Z三种元素,它们的单质在常温下皆为气体,X单质可在Z单质中燃烧生成XZ,其火焰为苍白色,化合物XZ极易溶于水,电离出X+和Z-,其水溶液可使蓝色石蕊试纸变红,说明X单质为H2,Z单质为Cl2,XZ为HCl;每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体,说明Y单质为O2,X2Y为H2O,Cl2溶于H2O中,反应生成HCl和HClO,HClO具有漂白作用.
(1)XZ为HCl,X2Y为H2O,故答案为:HCl;H2O;
(2)涉及到的3个化学反应方程式为:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl;2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;Cl2+H2O=HCl+HClO.
点评 本题考查无机物的推断,反应现象、物质性质及结构组成为推断突破口,需要学生熟练掌握元素化合物中等,题目难度不大.

练习册系列答案
相关题目
9.下列装置中四块相同的锌片,放置一段时间后腐蚀速率由快到慢的顺序是( )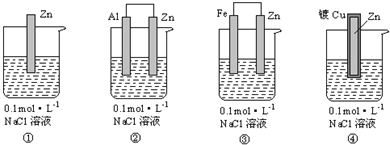

| A. | ③①②④ | B. | ④②①③ | C. | ①③②④ | D. | ④①②③ |
10.连二亚硫酸钠(Na2S2O4)是重要的化工原料,该物质在潮湿的空气中极不稳定,易分解并引起燃烧,反应的化学方程式为:2Na2S2O4═Na2S2O3+X+SO2↑.下列说法不正确的是( )
| A. | X的化学式为Na2SO4 | B. | SO2污染空气 | ||
| C. | Na2S2O3中S的化合价为+2 | D. | Na2S2O4要在干燥阴凉处密闭保存 |
14.在3个温度、容积相同的1L密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得一分钟后反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)??2NH3(g)△H=-92.4kJ•mol-1]:
(1)由以上数据,甲、乙、丙达平衡时,N2的浓度大小关系为甲=乙<丙,从反应开始到达到平衡,甲中以H2表示的反应速率是0.75 mol/(L•min).
(2)该温度下,丙中反应2NH3?N2+3H2的平衡常数是34.17.
(3)a+b=92.4(填“<”、“>”或“=”,下同);α1+α3<1.
(4)若要使甲重新达平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值变小,其他条件可采用BC.
A.使用催化剂 B.增大氮气浓度C.升高温度 D.缩小容器体积.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1=25% | α2 | α3 |
(2)该温度下,丙中反应2NH3?N2+3H2的平衡常数是34.17.
(3)a+b=92.4(填“<”、“>”或“=”,下同);α1+α3<1.
(4)若要使甲重新达平衡后$\frac{c(N{H}_{3})}{c({N}_{2})}$比值变小,其他条件可采用BC.
A.使用催化剂 B.增大氮气浓度C.升高温度 D.缩小容器体积.
4.将0.2molMnO2和含0.6molHCl的浓盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量(不考虑盐酸的挥发)( )
| A. | 一定等于0.3mol | B. | 一定小于0.3mol | C. | 一定大于0.3mol | D. | 可能等于0.3mol |
11. 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )| A. | 镁和铝消耗硫酸的物质的量之比是2:3 | |
| B. | 参加反应的镁、铝的质量之比是8:9 | |
| C. | 反应中消耗的镁、铝的物质的量之比是3:2 | |
| D. | 反应中镁、铝转移电子的物质的量之比是2:3 |
7.相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ•mol-1.实验没得反应在起始,达到平衡时的有关数据如表所示:
下列叙述不正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15kJ |
| ② | 0.6 | 1.8 | 0.8 | akJ |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 容器②中反应达到平衡时放出的热量为23.15 kJ | |
| C. | 达平衡时,两个容器中XY3的物质的量浓度均为2mol•L-1 | |
| D. | 若容器①体积为0.20L,则达平衡时放出的热量大于23.15kJ |
8.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol--1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| C. | 已知2C(s)+2O2(g)═2CO2(g)△H=akJ•mol--12C(s)+O2(g)═2CO(g)△H=bkJ•mol--1则a>b | |
| D. | 已知P (红磷,s)═P (白磷,s)△H>0,则白磷比红磷稳定 |
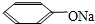 ;
;