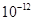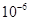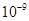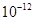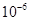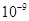题目内容
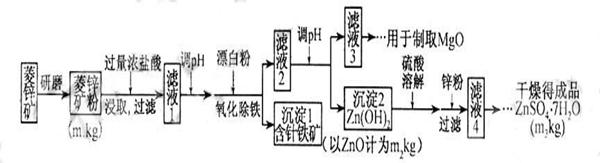
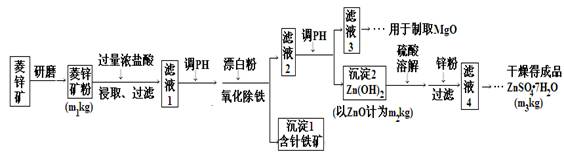
14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1) 将菱锌矿研磨成粉的目的是 。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
(5)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
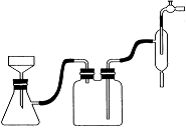
(6)抽滤装置如下图所示,该装置中的错误之处是___________;抽滤完毕或中途需停止抽滤时,应先_________________________,然后_______________________。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
(1)增大反应物的接触面积
(2) 2Fe(OH)2+ Cl- + H2O ==2 Fe(OH)3+CI-
(3) FeO(OH) 。(4) [8.0 10.4) 。 (5)蒸发浓缩 、冷却结晶。
(6)布氏漏斗的颈面斜口未朝向抽滤瓶的支管口 ;断开连接安全瓶与抽气装置间的橡皮管、关闭抽气装置中的水龙头。
(7)125m2/81m1
解析:(1)菱锌矿研磨成粉后可以增大反应物的接触面积,加快反应速率。
(2)根据铁元素的化合价变化可知氢氧化亚铁是还原剂,氢氧化铁是氧化产物。则氯离子是还原产物,所以氧化剂是氯气。根据得失电子守恒可进行配平。
(3)铁的相对原子质量是56,所以只能含有1个铁原子,89-56=33,所以化学式应为FeO(OH)。
(4)调节pH的目的是得到氢氧化锌沉淀,而镁离子留在溶液中,所以pH的最大范围是8.0~10.4.
(5)滤液4中含有硫酸锌,要得到硫酸锌晶体,需要蒸发浓缩然后冷却结晶,最后过滤即可。
(6)根据装置图可知布氏漏斗的颈面斜口未朝向抽滤瓶的支管口,是错误的。抽滤完毕或中途需停止抽滤时应先断开连接安全瓶与抽气装置间的橡皮管,然后关闭抽气装置中的水龙头。
(7)根据转化图可知沉淀2氢氧化锌来自于矿石中,氧化锌是m2g,则碳酸锌的质量是125m2g/81,所以菱锌矿粉中ZnCO3 的质量分数不低于125m2g/81÷m1=125m2g/81m1。

 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案(14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1)将菱锌矿研磨成粉的目的是 。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
| | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:

(1) 将菱锌矿研磨成粉的目的是 。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH |
10.4 |
6.4 |
— |
— |
|
沉淀完全的pH |
12.4 |
8.0 |
— |
— |
|
开始溶解的pH |
— |
10.5 |
— |
— |
|
Ksp |
5.6× |
— |
6.8× |
2.8× |
(5)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)抽滤装置如下图所示,该装置中的错误之处是___________;抽滤完毕或中途需停止抽滤时,应先_________________________,然后_______________________。

(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
(14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1)将菱锌矿研磨成粉的目的是 。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH |
10.4 |
6.4 |
— |
— |
|
沉淀完全的pH |
12.4 |
8.0 |
— |
— |
|
开始溶解的pH |
— |
10.5 |
— |
— |
|
Ksp |
5.6× |
— |
6.8× |
2.8× |
(5)工业上从“滤液3”制取MgO过程中,最合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。