题目内容
【题目】将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)。
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)。
(1)为加快反应速率可以采取的措施有____________、____________;
(2)不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________。
(3)下列能说明反应已达平衡的有____________ (填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
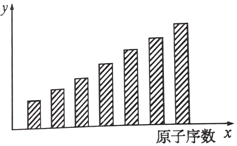
(4)室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=____________。若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时c(Mn2+) =____________ (不考虑离子水解的影响)。

(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为______。
【答案】升高温度 增大c(Sn2+) 构成多个微型原电池,加快反应速率 ACD 3 0.375molL-1 Mn2+ —2e- +2H2O=MnO2 + 4H+
【解析】
根据加快反应速率的因素有升温、加压、增大浓度、加入催化剂、增大接触面积、构成原电池加快反应速率等措施分析解答(1)、(2);
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(4)根据图像,平衡状态下Mn2+(aq)浓度为0.75mol/L,Sn2+(aq)浓度0.25mol/L,结合平衡常数表达式计算K;根据温度不变,平衡常数不变,分析判断;
(5)阳极发生氧化反应,锰由+2价变成+4价,据此书写阳极的电极反应式。
(1)反应Mn(s)+Sn2+(aq)Mn2+(aq)+Sn(s),压强影响不大,增大反应速率的因素主要是升温、增大c(Sn2+)离子浓度,故答案为:升高温度;增大c(Sn2+);
(2)不考虑温度因素,一段时间后,置换出的Sn与Mn构成多个微型原电池,加快反应速率,因此Mn的溶解速率加快,故答案为:构成多个微型原电池,加快反应速率;
(3)反应Mn(s)+Sn2+(aq)Mn2+(aq)+Sn(s)(已知含Sn2+水溶液为米黄色)。A.溶液的颜色不发生变化,说明离子浓度不变,说明反应达到平衡状态,故A正确;B.溶液中c(Mn2+)=c( Sn2+)和起始浓度有关,与平衡状态无直接关系,故B错误;C.体系中固体的质量不变,说明溶液中离子浓度不变,反应达到平衡状态,故C正确;D.Mn2+与Sn2+浓度的比值保持不变说明正逆反应速率相同,反应达到平衡状态,故D正确;故答案为:ACD;
(4)根据图像可知,平衡状态下Mn2+(aq)浓度为0.75mol/L,Sn2+(aq)浓度0.25mol/L,平衡常数K= =
=![]() =3;若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,由于温度不变,平衡常数不变,因此浓度变为原来的一半=
=3;若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,由于温度不变,平衡常数不变,因此浓度变为原来的一半=![]() ×0.75mol/L=0.375molL-1,故答案为:3;0.375molL-1;
×0.75mol/L=0.375molL-1,故答案为:3;0.375molL-1;
(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,故答案为:Mn2+-2e-+2H2O=MnO2+4H+。

 考前必练系列答案
考前必练系列答案【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D