题目内容
19.下列说法中正确的是( )| A. | 将苯加入溴水中振荡后,水层接近无色,是因为发生了取代反应 | |
| B. | 1 体积某气态烃与 HC1 充分加成消耗 HC11体积,加成后的物质最多还能和 5 体 积氯气发生取代反应,由此推断原气态烃是乙烯 | |
| C. | 乙醇与钠、氢氧化钠溶液均反应 | |
| D. | 等质量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同. |
分析 A.苯与溴水不反应;
B.与HCl以1:1加成,含双键,且加成后的物质最多还能和 5 体 积氯气发生取代反应,则加成产物含5个H;
C.乙醇含-OH,与Na反应生成氢气;
D.1mol乙烯和乙醇在氧气中充分燃烧均消耗3mol氧气,等质量时二者的物质的量不同.
解答 解:A.苯与溴水不反,发生萃取,故A错误应;
B.与HCl以1:1加成,含双键,且加成后的物质最多还能和 5 体 积氯气发生取代反应,则加成产物含5个H,则原气态烃是乙烯,故B正确;
C.乙醇含-OH,与Na反应生成氢气,与NaOH不反应,故C错误;
D.1mol乙烯和乙醇在氧气中充分燃烧均消耗3mol氧气,等质量时二者的物质的量不同,则消耗的氧气不同,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
17.下列离子方程式的书写中正确的是( )
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氧化铜溶于稀硫酸:CuO+2H+═Cu2++H2O | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
10.关于 16O,说法正确的是( )
| A. | 质子数为 16 | B. | 最外层电子数为 8 | ||
| C. | 与16N 互为同位素 | D. | 属于第二周期第 VIA 族元素 |
14.下列反应中,水只做还原剂的是( )
| A. | SO2+H2O→H2SO3 | B. | Cl2+H2O→HCl+HClO | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2Na+2H2O→2NaOH+H2↑ |
4.下列有关物质分离实验的说法错误的是( )
| A. |  过滤时,应将漏斗颈尖嘴处紧贴烧杯内壁 | |
| B. |  蒸发时,当溶液完全蒸干时应立即停止加热 | |
| C. |  蒸馏时,应将开始馏出的部分液体弃去 | |
| D. |  分液时,当下层液体刚好放完时应立即关闭活塞,以免上层液体流出 |
11.如图是某有机物分子的球棍模型,该物质中含C、H、O三种元素.则该物质不具有的性质是( )

| A. | 使紫色石蕊试液变红 | B. | 易溶于水 | ||
| C. | 发生酯化反应 | D. | 无色无味 |
2. 四氧化三锰(Mn3O4)在电子工业有广泛应用.
四氧化三锰(Mn3O4)在电子工业有广泛应用.
(1)金属锰与氧气在一定条件下反应可以制得Mn3O4,反应原理如图所示.
石墨为正极,该电极反应式为O2+2H2O+4e-=4OH-(或O2+2H2O+4NH4++4e-=4NH3•H2O).
(2)Mn3O4的一种工业制法:在常温下,往硫酸锰溶液中加入氨水,
控制溶液的pH 为10,使Mn2+转化为Mn(OH)2 沉淀,过滤,在NH4Cl 溶液
催化下通入氧气将滤渣氧化为Mn3O4.
①滤液中Mn2+的浓度为1.9×10-5mol/L(Ksp[Mn(OH)2]=1.9×10-13).
②滤渣转化为Mn3O4的化学方程式为6Mn(OH)2+O2$\frac{\underline{\;NH_{4}Cl\;}}{\;}$2Mn3O4+6H2O.
(3)加热MnCO3会同时发生如下三个反应:
①a<0(填“>”、“=”或“<”).
②已知2CO(g)+O2(g)=2CO2(g)△H=d kJ•mol-1,则3MnO2+2CO(g)?Mn3O4(s)+2CO2(g) 的△H=(3c+b-3a)kJ/mol.
③在300℃条件下加热MnCO3 制取Mn3O4 并不合适,理由是:该温度下生成Mn3O4的反应平衡常数小,Mn3O4不是主要产物.800℃时,Mn2O3(s)+$\frac{1}{2}$O2(g)?MnO2(s) 的平衡常数K=$\frac{9}{16}$.
 四氧化三锰(Mn3O4)在电子工业有广泛应用.
四氧化三锰(Mn3O4)在电子工业有广泛应用.(1)金属锰与氧气在一定条件下反应可以制得Mn3O4,反应原理如图所示.
石墨为正极,该电极反应式为O2+2H2O+4e-=4OH-(或O2+2H2O+4NH4++4e-=4NH3•H2O).
(2)Mn3O4的一种工业制法:在常温下,往硫酸锰溶液中加入氨水,
控制溶液的pH 为10,使Mn2+转化为Mn(OH)2 沉淀,过滤,在NH4Cl 溶液
催化下通入氧气将滤渣氧化为Mn3O4.
①滤液中Mn2+的浓度为1.9×10-5mol/L(Ksp[Mn(OH)2]=1.9×10-13).
②滤渣转化为Mn3O4的化学方程式为6Mn(OH)2+O2$\frac{\underline{\;NH_{4}Cl\;}}{\;}$2Mn3O4+6H2O.
(3)加热MnCO3会同时发生如下三个反应:
| 序号 | 反应 | △H(kJ•mol-1) | K | |
| 300°C | 800°C | |||
| Ⅰ | MnCO3(s)+$\frac{1}{2}$O2(g)?MnO2(s)+CO2(g) | a | 3.0×107 | 1.8×105 |
| Ⅱ | MnCO3(s)+$\frac{1}{4}$O2(g)?$\frac{1}{2}$Mn2O3(s)+CO2(g) | b | 1.7×103 | 2.4×105 |
| Ⅲ | MnCO3(s)+$\frac{1}{6}$O2(g)?$\frac{1}{3}$Mn3O4(s)+CO2(g) | c | 9.8 | 9.6×104 |
②已知2CO(g)+O2(g)=2CO2(g)△H=d kJ•mol-1,则3MnO2+2CO(g)?Mn3O4(s)+2CO2(g) 的△H=(3c+b-3a)kJ/mol.
③在300℃条件下加热MnCO3 制取Mn3O4 并不合适,理由是:该温度下生成Mn3O4的反应平衡常数小,Mn3O4不是主要产物.800℃时,Mn2O3(s)+$\frac{1}{2}$O2(g)?MnO2(s) 的平衡常数K=$\frac{9}{16}$.
3.有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)
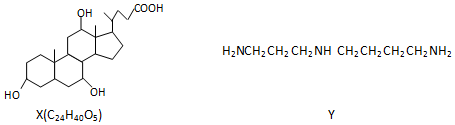
下列叙述错误的是( )
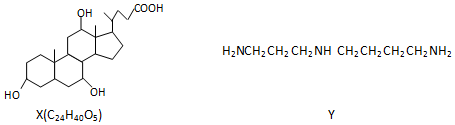
下列叙述错误的是( )
| A. | 1molX在浓硫酸作用下发生消去反应,最多生成3molH2O | |
| B. | 1molY发生类似酯化的反应,最多消耗2molX | |
| C. | X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 | |
| D. | Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |