��Ŀ����
����Ŀ��ij�о���ѧϰС�����ⶨ������(25 ����101 kPa)������Ħ���������ش��������⡣��С����Ƶļ���ʵ��װ������ͼ��ʾ��

��ʵ�����Ҫ�����������£�
����һ:
��1��������100 mL 1.0 mol��L��1������,��Ҫ20%,�ܶ�Ϊ1.1g��cm-3����������Ϊ______��
�����ƹ���������Ҫ�IJ���������__________________________________________��
�����в����ᵼ�����ʵ���Ũ��ƫ�����_________________
A��ת����Һ��δϴ���ձ��Ͳ�������ֱ�Ӷ���
B��������ƿ�н��ж���ʱ���ӿ̶���
C��������ƿ�н��ж���ʱ���ӿ̶���
D�����ݺ������ƿ����ҡ�ȣ�����Һ����ڿ̶��ߣ��ֲ�������ȱ��ˮ
�����: ����Ͳ��ȡ��10.0 mL 1.0 mol��L��1�����������ƿ�У�
������: ��2����ȡa g�ѳ�ȥ��������Ĥ��þ������ϵ��ͭ˿ĩ�ˣ�ΪʹHClȫ���μӷ�Ӧ��a����ֵ����Ϊ________��
������: �����ƿ��װ������ˮ������ͼ���Ӻ�װ�ã����װ�õ������ԣ�
������: ��3����Ӧ���������ϵ�¶Ȼָ������£���ȡ��Ͳ��ˮ�����ΪV mL��
��ʵ�鲽������Ӧѡ��________(�����)����Ͳ��
A��100 mL������B��200 mL������C��500 mL
�ڶ���ʱ���ָ�������,������Һ�尼Һ�����ʹ���ƽ�⣬��Ҫע��_____________________��
��������ˮ������Ӱ�죬��ʵ�������²������Ħ������ļ��㹫ʽΪVm��________����δ��ȥþ�����������Ĥ����������________(����ƫ������ƫС��������Ӱ����)��
���𰸡� 16.6mL ��Ͳ���ձ���100 mL����ƿ����ͷ�ιܣ������� C 0.12 B ��Ͳ�ڵ�Һ������ƿ��Һ����ƽ 0.2V L��mol��1 ƫС
��������������֪����ʵ��ԭ������һ����������������þ��Ӧ������������ˮ������ˮ����������������������������������ʵ���ȷ�����������ʵ��������һ�������µ�����Ħ�������
����һ:
��1����20%,�ܶ�Ϊ1.1g��cm-3����������ʵ���Ũ��Ϊ![]() mol/L������ϡ�Ͷ���c1V1=c2V2�����������100 mL 1.0 mol��L��1������,��Ҫ20%,�ܶ�Ϊ1.1g��cm-3����������Ϊ
mol/L������ϡ�Ͷ���c1V1=c2V2�����������100 mL 1.0 mol��L��1������,��Ҫ20%,�ܶ�Ϊ1.1g��cm-3����������Ϊ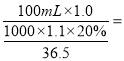 16.6mL��
16.6mL��
�����ƹ���������Ҫ�IJ�����������Ͳ���ձ���100 mL����ƿ����ͷ�ιܣ���������
��A��ת����Һ��δϴ���ձ��Ͳ�������ֱ�Ӷ��ݣ����ʼ��٣�Ũ��ƫС��B��������ƿ�н��ж���ʱ���ӿ̶��ߣ�Һ����ڿ̶��ߣ���Һ���ƫ��Ũ��ƫС��C��������ƿ�н��ж���ʱ���ӿ̶�����Һ����ڿ̶��ߣ�Ũ��ƫ��D�����ݺ������ƿ����ҡ�ȣ�����Һ����ڿ̶��ߣ��ֲ�������ȱ��ˮ����Һ�����ƫ���ˣ�Ũ��ƫС�����Ե������ʵ���Ũ��ƫ�����C��
�����: ����Ͳ��ȡ��10.0 mL 1.0 mol��L��1�����������ƿ�������Լ����n(H+)=0.01mol�������ܽ�þ�����ʵ���n(Mg)=1/2 n(H+)=0.005mol�������Ͽ����������������ʵ���Ϊ0.005mol����Щ�����ڱ�״�������Ϊ112mL��
������: ��2����ȡa g�ѳ�ȥ��������Ĥ��þ������ϵ��ͭ˿ĩ�ˣ�ΪʹHClȫ���μӷ�Ӧ��n(Mg)����Ϊ0.005mol��þ��Ħ������Ϊ24g/mol������a����ֵ����Ϊ0.12��
������: �����ƿ��װ������ˮ������ͼ���Ӻ�װ�ã����װ�õ������ԣ�
������: ��3����Ӧ���������ϵ�¶Ȼָ������£���ȡ��Ͳ��ˮ�����ΪV mL��
����Ͳ�е�ˮ�������ų��ģ�����ˮ�����������������������������ڱ�״�������Ϊ112mL����25 �桢101 kPa�¹��Ʋ��ᳬ��200mL��һ��ѹǿ�£��������������ѧ�¶ȳ����ȣ������ʵ�鲽������Ӧѡ��B��200 mL������Ͳ��
�ڶ���ʱ���ָ�������,������Һ�尼Һ�����ʹ���ƽ�⣬Ϊ��֤��Ӧװ��ϵͳ�����ѹǿ��ȣ���Ҫע����Ͳ�ڵ�Һ������ƿ��Һ����ƽ��������õ�����Ž�ȷ��
��������ˮ������Ӱ�죬��ʵ�������²������Ħ������ļ��㹫ʽΪVm��![]() =0.2V L��mol��1����δ��ȥþ�����������Ĥ�������ɵ�����������٣�ʹ�������ƫС��
=0.2V L��mol��1����δ��ȥþ�����������Ĥ�������ɵ�����������٣�ʹ�������ƫС��

����Ŀ��һ�������£���2L�����ܱ������г���1mol PCl5 �� ������Ӧ��PCl5��g��PCl3��g��+Cl2��g�� ��Ӧ�����вⶨ�IJ������ݼ�������Ӧ�������������䣩��
t/s | 0 | 30 | 150 | 250 | 350 | 450 |
n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x |
��ش��������⣺
��1��x ��ֵ����
��2��0��50s �ڣ���PCl3��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ��������
��3��250s �Ժ�Cl2�����ʵ������ٸı��ԭ������
��4��250s ʱ��������Cl2�����ʵ����� �� PCl5�����ʵ����� �� PCl5��ת������ ��
