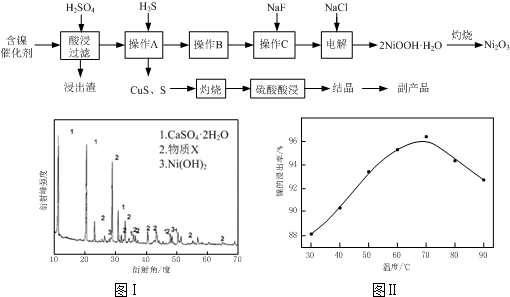
题目内容
 某同学设计了如下两种制备氢氧化铝的方案:
某同学设计了如下两种制备氢氧化铝的方案:方案①2.7g Al
| 100mL盐酸 |
| NaOH溶液 |
方案②2.7g Al
| 100mLNaOH |
| HCl溶液 |
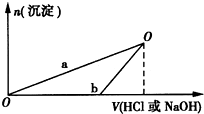
已知NaOH溶液和盐酸的物质的量浓度均是3mol?L-1.如图所示是向X溶液和Y溶液中分别加入NaOH溶液和盐酸时产生沉淀的物质的量与加入NaOH溶液和盐酸体积之间的关系.下列说法不正确的是( )
分析:铝的物质的量=
=0.1mol,n(HCl)=n(NaOH)=3mol?L-1×0.1L=0.3mol,根据反应:2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑知酸恰好反应、碱过量,
A.根据铝和氢氧化钠反应的关系式确定Y的溶质;
B.Y溶液中的溶质是偏铝酸钠和氢氧化钠,向其溶液中加入盐酸,盐酸先和氢氧化钠反应;
C.酸恰好和铝反应,所以X溶液中的溶质是氯化铝,向氯化铝溶液中加入氢氧化钠会立即产生沉淀;
D.根据原子守恒判断.
| 2.7g |
| 27g/mol |
A.根据铝和氢氧化钠反应的关系式确定Y的溶质;
B.Y溶液中的溶质是偏铝酸钠和氢氧化钠,向其溶液中加入盐酸,盐酸先和氢氧化钠反应;
C.酸恰好和铝反应,所以X溶液中的溶质是氯化铝,向氯化铝溶液中加入氢氧化钠会立即产生沉淀;
D.根据原子守恒判断.
解答:解:铝的物质的量=
=0.1mol,n(HCl)=n(NaOH)=3mol?L-1×0.1L=0.3mol,根据反应:2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑知酸恰好反应、碱过量,
A.通过以上分析知,铝和氢氧化钠溶液反应时,碱过量,所以Y溶液中的溶质是偏铝酸钠和氢氧化钠,故A错误;
B.Y中的溶质是偏铝酸钠和氢氧化钠,向Y溶液中加入盐酸时,盐酸先和氢氧化钠反应,当氢氧化钠完全反应后,盐酸再和偏铝酸钠反应生成氢氧化铝沉淀,根据图象知,b曲线表示的是向Y溶液中加入盐酸,故B正确;
C.通过以上分析知,铝和盐酸恰好反应,所以溶液中的溶质是氯化铝,向氯化铝中加入氢氧化钠溶液,立即产生沉淀,所以a曲线表示的是向X溶液中加入NaOH溶液,故C正确;
D.在O点时,沉淀达到最大,所得溶液中只有氯化钠溶质,与向X溶液和Y溶液中分别加入NaOH和HCl的浓度及体积相等,根据原子守恒得O点时两方案中所得溶液浓度相等,故D正确;
故选A.
| 2.7g |
| 27g/mol |
A.通过以上分析知,铝和氢氧化钠溶液反应时,碱过量,所以Y溶液中的溶质是偏铝酸钠和氢氧化钠,故A错误;
B.Y中的溶质是偏铝酸钠和氢氧化钠,向Y溶液中加入盐酸时,盐酸先和氢氧化钠反应,当氢氧化钠完全反应后,盐酸再和偏铝酸钠反应生成氢氧化铝沉淀,根据图象知,b曲线表示的是向Y溶液中加入盐酸,故B正确;
C.通过以上分析知,铝和盐酸恰好反应,所以溶液中的溶质是氯化铝,向氯化铝中加入氢氧化钠溶液,立即产生沉淀,所以a曲线表示的是向X溶液中加入NaOH溶液,故C正确;
D.在O点时,沉淀达到最大,所得溶液中只有氯化钠溶质,与向X溶液和Y溶液中分别加入NaOH和HCl的浓度及体积相等,根据原子守恒得O点时两方案中所得溶液浓度相等,故D正确;
故选A.
点评:本题考查了铝及物质的量的有关计算,明确溶液中的溶质是解本题关键,结合方程式来分析解答,难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目