题目内容
8.3A(g)+2B(g)?2C(g)+3D(g).在温度和体积都相同的条件下分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol.四个选项中错误的是( )| A. | 达平衡时,①途径的反应速率vA不等于②途径的反应速率vA | |
| B. | ①、②都达到平衡时,体系内混合气体的平均相对摩尔质量相同 | |
| C. | ①、②都达到平衡时,体系内混合气体的组成百分比相同 | |
| D. | 达平衡时,①途径所得混合气的密度为②途径所得混合气密度相同 |
分析 在温度和体积都相同的条件下发生反应:3A(g)+2B(g)?2C(g)+3D(g),分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol,将②一边倒,转化为等效平衡初始条件为A、B的起始物质的量为6mol和4mol,则②相当于对①加压,反应为气体数不变的反应,压强改变不对化学平衡产生影响,据此判断分析.
解答 解:在温度和体积都相同的条件下发生反应:3A(g)+2B(g)?2C(g)+3D(g),分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol,将②一边倒,转化为等效平衡初始条件为A、B的起始物质的量为6mol和4mol,则②相当于对①加压,反应为气体数不变的反应,压强改变不对化学平衡产生影响,
A.达平衡时,由于②相对于①加压,加压可使化学反应速率增大,则,①途径的反应速率v(A)不等于②途径的反应速率v(A),故A正确;
B.反应为气体数不变的反应,压强改变不改变化学平衡的状态,体系内混合气体的平均摩尔质量为$\overline{{M}_{r}}$=$\frac{m}{n}$,②相当于对①加压,二者为等效平衡,则①、②都达到平衡时,体系内混合气体的平均相对摩尔质量相同,故B正确;
C.反应为气体数不变的反应,压强改变不改变化学平衡的状态,②相当于对①加压,二者为等效平衡,则①、②都达到平衡时,体系内混合气体的组成百分比相同,故C正确;
D.①中和②中反应虽为等效平衡,但起始和平衡时各组分的物质的量不相同,体系的总质量不相同,体积相同,则混合气体的密度为$ρ=\frac{m}{V}$也不相同,因此达平衡时,①途径所得混合气的密度为②途径所得混合气密度不相同,故D错误.
故选D.
点评 本题考查等效平衡原理的运用,恒温恒容条件下,反应前后气体分子数不变,按等比例冲入,反应可达到等效平衡,也可从平衡常数角度理解,等效平衡是高考考查的重点和难点,需要加强这方面知识的理解和运用,本题难度中等.

 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案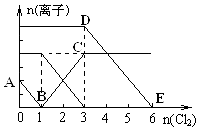 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+ 物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 |
| A. | 苯甲酸易溶于水,可做食品防腐剂 | |
| B. | 提纯苯甲酸的过程中需要用到的玻璃仪器:烧杯、玻璃棒、漏斗 | |
| C. | 粗品中苯甲酸溶解后,还需再加入少量蒸馏水,以减少产品的损失 | |
| D. | 为了获得更多的苯甲酸,此实验中结晶温度越低越好 |
| A. | K2CO3(NH4Cl):加热 | |
| B. | CO2(SO2):饱和碳酸钠溶液、浓硫酸,洗气 | |
| C. | KCl溶液(BaCl2):加入适量K2SO4溶液,过滤. | |
| D. | 蛋白质(葡萄糖):浓Na2SO4溶液,盐析、过滤、洗涤 |
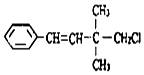
| A. | 一定条件下,能发生加聚反应 | |
| B. | 该有机物苯环上的一溴代物有3种 | |
| C. | 能使酸性KMnO4溶液、溴水褪色,且原理相同 | |
| D. | 1mol该有机物在一定条件下最多能与4molH2发生反应 |
| A. | 纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| B. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 | |
| C. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
 意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4的沸点比P4(白磷)的高 | |
| C. | 理论上可以将N4转化为N2的反应设计成原电池 | |
| D. | 1mol N4所含有的能量比2mol N2所含有的能量高 |
①CH2=CH2+CI2+H2O→CICH2CH2OH+HCI
②

总的反应可表示为:

现代石油化式采用银作催化剂,可一步完成例:

经典的生产工艺的原子利用率是( )
| A. | 12.7% | B. | 25.4% | C. | 50.8% | D. | 76.2% |
| 弱酸 | HCOOH | HCN | H2CO3 | HNO2 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=4.0×10-4 |
| A. | 甲酸和碳酸的分子式中均含两个氢原子,均属于二元酸 | |
| B. | 向NaCN溶液中通入少量的CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HNO2消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |