题目内容
(1)在下列物质①NH3、②BF3、③HCl、④SO3,属于非极性分子的是(填番号)________________。
(2)试比较含氧酸的酸性强弱(填“>”、“<”或“=”): HClO3________HClO4。
(3)根据价层电子对互斥理论判断:H2O的VSEPR构型为 。
(4)沸点比较:邻羟基苯甲醛 对羟基苯甲醛(填“>”、“<”或“=”),原因是__________
(2)试比较含氧酸的酸性强弱(填“>”、“<”或“=”): HClO3________HClO4。
(3)根据价层电子对互斥理论判断:H2O的VSEPR构型为 。
(4)沸点比较:邻羟基苯甲醛 对羟基苯甲醛(填“>”、“<”或“=”),原因是__________
(1)②④(1分)
(2)< (1分)
(3)四面体形(1分)
(4)<(1分)
(2)< (1分)
(3)四面体形(1分)
(4)<(1分)
试题分析:(1)对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子。故非极性分子为②④。
(2)同种元素的元素的化合价越高,对应的含氧酸的酸性越强。
(3)H2O中心原子O原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,VSEPR构型为四面体形。
(4)对羟基苯甲醛的沸点高于邻羟基苯甲醛,因为对羟基苯甲醛形成分子间氢键使沸点升高,而邻羟基苯甲醛形成的是分子内氢键 。

练习册系列答案
相关题目
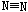 放出942KJ能量,根据以上信息和数据判断下列说法正确的是( )
放出942KJ能量,根据以上信息和数据判断下列说法正确的是( )
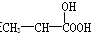 分子中含有1个手性C原子
分子中含有1个手性C原子