题目内容
(2011?万州区一模)氨气是一种重要的物质,可用于制取化肥和硝酸等.
(1)工业合成氨的热化学方程式:N2(g)+3H2(g)?2NH3(g);△H=-92.2KJ/mol.有关键能: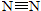 :946.5KJ/mol;N-H:391.0KJ/mol;则H-H键能为
:946.5KJ/mol;N-H:391.0KJ/mol;则H-H键能为
(2)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:已知1molH2O(g)转变为1molH2O(l)时放热44.0KJ.写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式
(3)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
(1)工业合成氨的热化学方程式:N2(g)+3H2(g)?2NH3(g);△H=-92.2KJ/mol.有关键能:
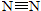 :946.5KJ/mol;N-H:391.0KJ/mol;则H-H键能为
:946.5KJ/mol;N-H:391.0KJ/mol;则H-H键能为436.1kJ/mol
436.1kJ/mol
.(2)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:已知1molH2O(g)转变为1molH2O(l)时放热44.0KJ.写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol
.| 物质 | △H(KJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
NH4HSO4、(NH4)2SO4
NH4HSO4、(NH4)2SO4
,溶液中离子浓度从大到小的顺序是c(NH+)>c(SO42-)>c(H+)>c(OH-)
c(NH+)>c(SO42-)>c(H+)>c(OH-)
.分析:(1)根据反应热等于反应物的总键能减去生成物的总键能来计算;
(2)根据燃烧热的概念来书写热化学方程式,然后运用盖斯定律来解答;
(3)氨气和酸反应生成对应的盐,根据水解解原理、电离原理来比较离子浓度的大小.
(2)根据燃烧热的概念来书写热化学方程式,然后运用盖斯定律来解答;
(3)氨气和酸反应生成对应的盐,根据水解解原理、电离原理来比较离子浓度的大小.
解答:解:(1)因反应热等于反应物的总键能减去生成物的总键能,设H-H键能为 xKJ/mol,则
945.6kJ/mol+3xKJ/mol-6×391.0kJ/mol=-92.2kJ/mol 解得x=436.1,
故答案为:436.1kJ/mol;
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
H2(g)+
O2(g)═H2O(l)△H=-285.8KJ/mol ②
CO(g)+
O2(g)═CO2(g)△H=-283KJ/mol ③
而H2O(g)═H2O(l)△H=44.0kJ/mol ④
根据盖斯定律:④+①-②×3-③,得
CH4(g)+H2O(g)═CO(g)+3H2(g)的△H=44KJ/mol-890.3KJ/mol+285.8KJ/mol×3+283KJ/mol=+206.1kJ/mol,
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol;
(3)6.72L即0.3mol氨气通入到100g19.6%即0.2mol的硫酸溶液中:NH3+H2SO4=NH4HSO4,生成0.2molNH4HSO4,NH3过量0.1mol,与NH4HSO4反应:NH3+NH4HSO4=(NH4)2SO4,生成0.1mol(NH4)2SO4,过量0.1molNH4HSO4,所以溶质为NH4HSO4、(NH4)2SO4,NH4HSO4能电离出等量的铵根、氢离子和硫酸根,(NH4)2SO4电离出铵根、硫酸根,虽然铵根离子水解,但浓度最大,故答案为:NH4HSO4、(NH4)2SO4;c(NH+)>c(SO42-)>c(H+)>c(OH-).
945.6kJ/mol+3xKJ/mol-6×391.0kJ/mol=-92.2kJ/mol 解得x=436.1,
故答案为:436.1kJ/mol;
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
而H2O(g)═H2O(l)△H=44.0kJ/mol ④
根据盖斯定律:④+①-②×3-③,得
CH4(g)+H2O(g)═CO(g)+3H2(g)的△H=44KJ/mol-890.3KJ/mol+285.8KJ/mol×3+283KJ/mol=+206.1kJ/mol,
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol;
(3)6.72L即0.3mol氨气通入到100g19.6%即0.2mol的硫酸溶液中:NH3+H2SO4=NH4HSO4,生成0.2molNH4HSO4,NH3过量0.1mol,与NH4HSO4反应:NH3+NH4HSO4=(NH4)2SO4,生成0.1mol(NH4)2SO4,过量0.1molNH4HSO4,所以溶质为NH4HSO4、(NH4)2SO4,NH4HSO4能电离出等量的铵根、氢离子和硫酸根,(NH4)2SO4电离出铵根、硫酸根,虽然铵根离子水解,但浓度最大,故答案为:NH4HSO4、(NH4)2SO4;c(NH+)>c(SO42-)>c(H+)>c(OH-).
点评:本题主要考查反应热的计算,水解原理,应加强基础知识的学习,(3)中溶液中的溶质的确定为易错点.

练习册系列答案
相关题目
 (2011?万州区一模)图是钢铁在酸雨环境中腐蚀的示意图.有关说法正确的是( )
(2011?万州区一模)图是钢铁在酸雨环境中腐蚀的示意图.有关说法正确的是( )