题目内容
有CO与CO2的混合气体共33.6L,其密度为1.7g/L,已知混合气体共有9.03×1023个分子,则该混合气体的平均摩尔质量是多少?CO与CO2的分子个数比是多少?
混合气体的物质的量:
=1.5mol
混合气体的质量:33.6L×1.7g/L=57.12g
混合气体的平均摩尔质量:
=
=38.08g/mol
取混合气体的平均摩尔质量近似为38g/mol,利用十字交叉法来求算CO与CO2的分子个数比:
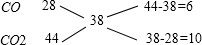
所以,N(CO):N(CO2)=6:10=3:5
| 9.03×1023 |
| 6.02×1023mol-1 |
混合气体的质量:33.6L×1.7g/L=57.12g
混合气体的平均摩尔质量:
| . |
| M |
| 33.6L×1.7g/L |
| 1.5mol |
取混合气体的平均摩尔质量近似为38g/mol,利用十字交叉法来求算CO与CO2的分子个数比:

所以,N(CO):N(CO2)=6:10=3:5

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目