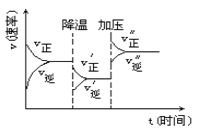
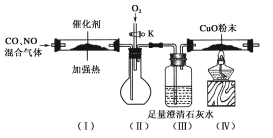
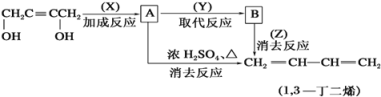
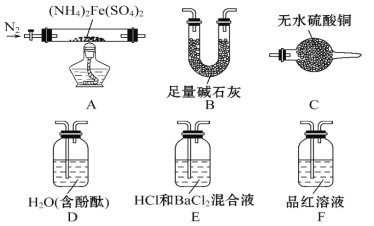
题目内容
【题目】部分弱电解质的电离常数如下表:
弱电解质 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数3.67×105
HCN+ HCOO-的化学平衡常数3.67×105
【答案】B
【解析】
A.由HCOOH 、HCN 的电离常数Ka=1.8×10-4、Ka=4.9×10-10,H2CO3的电离常数Ka1=4.3×10-7 、Ka2=5.6×10-11, 结合H+的能力:CO32->CN->HCO3->HCOO-,故A正确;B.根据电离平衡常数有CN-+H2O+CO2=HCN+HCO3-,故B错误;C.因为HCOOH比HCN酸性强,中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;D. 25 ℃时,反应HCOOH + CN-![]() HCN+ HCOO-的化学平衡常数K=c HCOO-)
HCN+ HCOO-的化学平衡常数K=c HCOO-)![]() c(HCN)/cHCOOH )
c(HCN)/cHCOOH )![]() c(CN-)= Ka(HCOOH)/ Ka((HCN)= 1.8×10-4/4.9×10-10 =3.67×105,故D正确。答案:B。
c(CN-)= Ka(HCOOH)/ Ka((HCN)= 1.8×10-4/4.9×10-10 =3.67×105,故D正确。答案:B。

练习册系列答案
相关题目