题目内容
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):
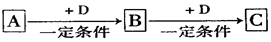
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为 (填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程
式表示) ;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式 。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则固体混合物中Mg的质量为 ;NaOH溶液的物质的量浓度为 。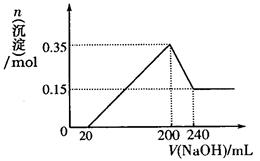
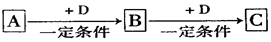
试回答:
(1)若D是具有氧化性的单质,则属于主族的金属A为 (填元素符号)
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程
式表示) ;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式 。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则固体混合物中Mg的质量为 ;NaOH溶液的物质的量浓度为 。

(1)Na(1分)
(2)加入少量铁,防止Fe2+被氧化为Fe3+(1分);2Fe3++Fe = 3Fe2+(1分)
O2+2H2O+4e— = 4OH—(1分)
(3)Al(OH)3+3H+ = Al3++3H2O (1分)Al(OH)3+OH—= AlO2—+2H2O(1分)
3.6g(2分) 5mol·L—1(2分)
(2)加入少量铁,防止Fe2+被氧化为Fe3+(1分);2Fe3++Fe = 3Fe2+(1分)
O2+2H2O+4e— = 4OH—(1分)
(3)Al(OH)3+3H+ = Al3++3H2O (1分)Al(OH)3+OH—= AlO2—+2H2O(1分)
3.6g(2分) 5mol·L—1(2分)
(1)若D是具有氧化性的单质,则属于主族的金属A应该是钠,B是氧化钠,D是过氧化钠。
(2)若D是金属,C溶液在储存时应加入少量D,则D是铁。由于亚铁离子具有还原性,易被氧化生成铁离子,而单质铁能还原铁离子,方程式为2Fe3++Fe = 3Fe2+;钢铁发生吸氧腐蚀时,正极是氧气得到电子,方程式为O2+2H2O+4e— = 4OH—。
(3)根据题意可知,金属应该是铝,所以B是氢氧化铝,而C可能是Al3+,也可能是AlO2-,所以B生成C的方程式为Al(OH)3+3H+ = Al3++3H2O 、Al(OH)3+OH—= AlO2—+2H2O;
(4)E是Al,所以根据图像可知,硫酸是过量的,则0~20ml氢氧化钠是中和硫酸的,20~200ml是沉淀镁离子和铝离子的;200~240ml是溶解氢氧化铝的。因此0.15mol是氢氧化镁沉淀,则镁的质量是0.15mol×24g/mol=3.6g;氢氧化铝是0.2mol,则溶解0.2mol氢氧化铝消耗的氧化钠是0.2mol,所以氢氧化钠溶液的浓度是0.2mol÷0.04L=5.0mol/L。
(2)若D是金属,C溶液在储存时应加入少量D,则D是铁。由于亚铁离子具有还原性,易被氧化生成铁离子,而单质铁能还原铁离子,方程式为2Fe3++Fe = 3Fe2+;钢铁发生吸氧腐蚀时,正极是氧气得到电子,方程式为O2+2H2O+4e— = 4OH—。
(3)根据题意可知,金属应该是铝,所以B是氢氧化铝,而C可能是Al3+,也可能是AlO2-,所以B生成C的方程式为Al(OH)3+3H+ = Al3++3H2O 、Al(OH)3+OH—= AlO2—+2H2O;
(4)E是Al,所以根据图像可知,硫酸是过量的,则0~20ml氢氧化钠是中和硫酸的,20~200ml是沉淀镁离子和铝离子的;200~240ml是溶解氢氧化铝的。因此0.15mol是氢氧化镁沉淀,则镁的质量是0.15mol×24g/mol=3.6g;氢氧化铝是0.2mol,则溶解0.2mol氢氧化铝消耗的氧化钠是0.2mol,所以氢氧化钠溶液的浓度是0.2mol÷0.04L=5.0mol/L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

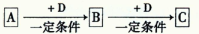

 原子失去一个电子后变成一个质子
原子失去一个电子后变成一个质子