题目内容
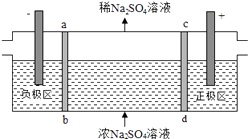
【题目】瑞典ASES公司设计的曾用于驱动潜艇的液氨﹣液氧燃料电池示意图如图所示,下列有关说法正确的是( ) 
A.电池工作时,Na+向电极1移动
B.电池工作一段时间后停止,溶液PH值比开始时明显减小
C.电极1发生的电极反应为2NH3+6OH﹣﹣6e﹣═N2↑+6H2O
D.用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜
【答案】BC
【解析】解:A.1为负极,原电池工作时,阳离子向正极移动,故A错误; B.总方程式为4NH3+3O2=2N2+6H2O,生成水,溶液体积增大,pH减小,故B正确;
C.在燃料电池的负极上发生燃料氨气失电子的氧化反应,则碱性环境下电极1发生的电极反应为:2NH3+6OH﹣﹣6e﹣=N2↑+6H2O,故C正确;
D.由2NH3+6OH﹣﹣6e﹣=N2↑+6H2O可知,理论上每消耗0.2 mol NH3 , 可转移0.6mol电子,但阳极不是纯铜,阳极发生氧化反应,故D错误.
故选BC.

 阅读快车系列答案
阅读快车系列答案【题目】下列各组物质中,物质之间不可能实现如下转化的是:X ![]() Y
Y ![]() Z.( )
Z.( )
选 项 | X | Y | Z | M |
A | NH3 | NO | NO2 | O2 |
B | NaOH | Na2SO3 | NaHSO3 | SO2 |
C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
D | Mg | C | CO | CO2 |
A.A
B.B
C.C
D.D
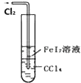
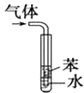
【题目】下列实验操作说法正确的是( )
选项 | 实验操作 | 现象与结论(或装置用途) |
A | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸 | 试纸变蓝,说明NH3是碱 |
B |
| 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
C | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
D |
| 用于吸收HCl气体能防倒吸 |
A.A
B.B
C.C
D.D
【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行