题目内容
(9分)海洋植物,如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
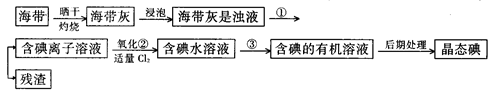
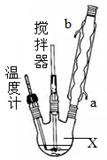
(1)指出提取碘的过程中有关的实验操作名称:
① ;③______________________。
写出实验②中有关反应的离子方程式 _______________________ 。
(2)提取碘的过程中,可供选择的有关试剂是___________。

(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处:① ② ③ 。
(4)进行上述蒸馏操作时,使用水浴的原因是___________;最后,晶态碘在___________里聚集。

(1)指出提取碘的过程中有关的实验操作名称:
① ;③______________________。
写出实验②中有关反应的离子方程式 _______________________ 。
(2)提取碘的过程中,可供选择的有关试剂是___________。
| A.甲苯,酒精 | B.四氯化碳,苯 |
| C.汽油,乙酸 | D.汽油,甘油 |

(3)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,指出上图实验装置中的错误之处:① ② ③ 。
(4)进行上述蒸馏操作时,使用水浴的原因是___________;最后,晶态碘在___________里聚集。
⑴过滤;萃取;2I-+Cl2 = I2+2Cl- ⑵B
⑶①缺石棉网;②温度计插到了液体中;③冷凝管进、出水的方向颠倒。
⑷使蒸馏烧瓶均匀受热、控制加热温度不会过高 蒸馏烧瓶
⑶①缺石棉网;②温度计插到了液体中;③冷凝管进、出水的方向颠倒。
⑷使蒸馏烧瓶均匀受热、控制加热温度不会过高 蒸馏烧瓶
试题分析:⑴①分离固体和液体用过滤,③将碘水中的碘单质萃取出来,选择合适的萃取剂萃取分液即可;实验②向含碘离子溶液中通入氯气,氯气将碘离子氧化生成碘单质;
⑵萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,可用四氯化碳或苯,故选B;
⑶冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平;
⑷水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.四氯化碳沸点:76.8℃,碘单质沸点为184℃,故最后晶态碘在蒸馏烧瓶里聚集。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下: