题目内容
【题目】中国科学家屠呦呦因青蒿素的研究荣获了2015年诺贝尔奖.由青蒿素合成系列衍生物(它们的名称和代号如图所示)的路线如下: 
己知氢化青蒿素的分子式为C15H22O4 . 回答下列问题:
(1)青蒿素的分子式为 .
(2)反应①中,NaBH4的作用是 .
A.氧化剂
B.还原剂
C.催化剂
D.溶剂
(3)有机物D的结构简式为 .
(4)青蒿琥酯能够发生的反应类型有 .
A.酯化化反应
B.水解反应
C.还原反应
D.加聚反应
(5)参照H2Q的表示方式,写出反应②的化学方程式 .
(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E.合成过程中,有机原料除H2Q、 ![]() 外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
【答案】
(1)C15H22O5
(2)B
(3)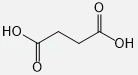 (或
(或![]() )
)
(4)A,B,C
(5)![]()
(6)![]() ;
;![]() (或
(或 , 其他合理答案亦可)
, 其他合理答案亦可)
【解析】(1)根据结构简式确定青蒿素的分子式为C15H22O5 , 所以答案是:C15H22O5;(2)反应①中反应前后有机物多了H原子,所以该反应是还原反应,则NaBH4作还原剂,故选B;(3)根据双氢青蒿素和青蒿琥酯结构简式确定有机物D的结构简式为 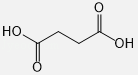 (或
(或 ![]() ),所以答案是:
),所以答案是:  (或
(或 ![]() );(4)青蒿琥酯中含有醚键、过氧键、酯基和羧基,具有醚、过氧化物、酯和羧酸性质,能发生酯化化反应、水解反应、还原反应,故选ABC;(5)反应②为醇之间的取代反应生成醚,反应方程式为
);(4)青蒿琥酯中含有醚键、过氧键、酯基和羧基,具有醚、过氧化物、酯和羧酸性质,能发生酯化化反应、水解反应、还原反应,故选ABC;(5)反应②为醇之间的取代反应生成醚,反应方程式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E,合成过程中,有机原料除H2Q、
;(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E,合成过程中,有机原料除H2Q、 ![]() 外,还需含苯环的二羟基化合物P,其结构简式为
外,还需含苯环的二羟基化合物P,其结构简式为 ![]() ;化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,S中含有醚键和酚羟基,且二者位于对位或含有甲基和两个酚羟基,且三个取代基位于间位,据此确定S的一种结构简式为
;化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,S中含有醚键和酚羟基,且二者位于对位或含有甲基和两个酚羟基,且三个取代基位于间位,据此确定S的一种结构简式为 ![]() (或
(或  ,其他合理答案亦可给分), 所以答案是:
,其他合理答案亦可给分), 所以答案是: ![]() ;
; ![]() (或
(或  ,其他合理答案亦可).
,其他合理答案亦可).

【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为 .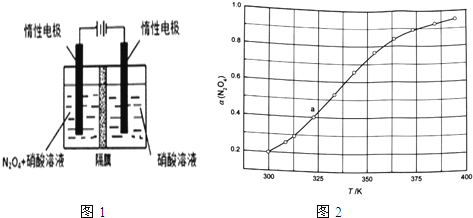
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H= .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为P0 , 第2.00min时体系压强为p,则p:p0= ;
1.00~3.00min内,O2的平均反应速率为 .
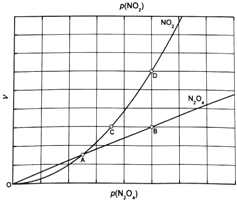
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由 ,若要提高N2O4转化率,除改变反应温度外,其他措施有 (要求写出两条).
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由 .