题目内容
(8分)右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该盐酸中HCl的物质的量浓度为 mol?L–1
(2)某同学用上述浓盐酸和蒸馏水配制浓度为0.4mol?L–1体积为425 mL的稀盐酸。
①该学生需要取 mL上述浓盐酸进行配制。
②配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 、
。
③上述实验中,需要用到玻璃棒,其作用是 、 。
④在配制过程中,下列操作对配制的稀盐酸的物质的量浓度有何影响(填“偏大”、“偏小”或“无影响” )
I.用量筒量取浓盐酸时俯视观察凹液面
II.定容时仰视刻度线

(1)该盐酸中HCl的物质的量浓度为 mol?L–1
(2)某同学用上述浓盐酸和蒸馏水配制浓度为0.4mol?L–1体积为425 mL的稀盐酸。
①该学生需要取 mL上述浓盐酸进行配制。
②配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 、
。
③上述实验中,需要用到玻璃棒,其作用是 、 。
④在配制过程中,下列操作对配制的稀盐酸的物质的量浓度有何影响(填“偏大”、“偏小”或“无影响” )
I.用量筒量取浓盐酸时俯视观察凹液面
II.定容时仰视刻度线
(1)11.9 (2) ① 16.8 ② 胶头滴管、容量瓶500mL ③搅拌溶解、引流④偏小、偏小
试题分析:(1)c=
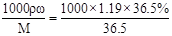 =11.9mol/L。(2)没有425mL的容量瓶,与其接近的容量瓶为500mL,根据c(稀)V(稀)=c(浓)V(浓),0.4mol/L×500mL=11.9mol/L×V,可求得需要浓盐酸16.8mL。配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需胶头滴管、容量瓶500mL。玻璃棒的作用是搅拌溶解、引流。根据c=
=11.9mol/L。(2)没有425mL的容量瓶,与其接近的容量瓶为500mL,根据c(稀)V(稀)=c(浓)V(浓),0.4mol/L×500mL=11.9mol/L×V,可求得需要浓盐酸16.8mL。配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需胶头滴管、容量瓶500mL。玻璃棒的作用是搅拌溶解、引流。根据c=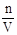 ,用量筒量取浓盐酸时俯视观察凹液面,量取的盐酸比正常值小,所以偏小。定容时仰视刻度线,溶液的体积比正常值大,所以偏小。
,用量筒量取浓盐酸时俯视观察凹液面,量取的盐酸比正常值小,所以偏小。定容时仰视刻度线,溶液的体积比正常值大,所以偏小。点评:这类习题是专项考查一定物质的量浓度的习题,难度较低,比较基础。

练习册系列答案
相关题目



