题目内容
现有表面覆盖铁锈的铁块58.16 g,与足量稀H2SO4反应,可放出22.4 L(标准状况下)H2。反应后溶液中加入KSCN溶液不显红色。求原铁块被氧化的铁的质量。
1.12 g
Fe+H2SO4====FeSO4+H2↑
56 g 1 mol
Fe2O3+3H2SO4====Fe2(SO4)3+3H2O
X x
Fe2(SO4)3+Fe====2FeSO4
X y
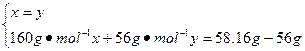
x="y=0.01" mol
4Fe+3O2====2Fe2O3
0.02 mol 0.01 mol
被氧化的铁的质量m(Fe)="0.02" mol×56 g·mol-1="1.12" g
56 g 1 mol
Fe2O3+3H2SO4====Fe2(SO4)3+3H2O
X x
Fe2(SO4)3+Fe====2FeSO4
X y
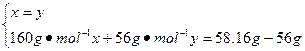
x="y=0.01" mol
4Fe+3O2====2Fe2O3
0.02 mol 0.01 mol
被氧化的铁的质量m(Fe)="0.02" mol×56 g·mol-1="1.12" g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Fe(OH)2+2H+。若向硝酸亚铁溶液中加入盐酸,观察到的现象是( )
Fe(OH)2+2H+。若向硝酸亚铁溶液中加入盐酸,观察到的现象是( )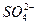 )
)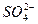 、Cl-外,还含有的金属阳离子是( )
、Cl-外,还含有的金属阳离子是( )