题目内容
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系正确的是
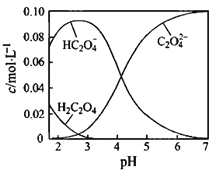
A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B. c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C. c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D. pH=7的溶液中:c(Na+)=2c(C2O42-)
【答案】B
【解析】A、由图象可知,pH=2.5的溶液中c(H2C2O4)和c(C2O42-)浓度之和小于c(HC2O4-),则c(H2C2O4)+c(C2O42-)<c(HC2O4-),故A错误;B、依据溶液中电荷守恒和物料守恒分析,c(Na+)=0.100mol·L-1的溶液中为NaHC2O4溶液,溶液中存在电荷守恒c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),物料守恒c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),代入计算得到c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-),故B正确;C、c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1,c(HC2O4-)=c(C2O42-),电荷守恒(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),pH约4,此时氢离子浓度大于氢氧根,得到溶液中c(Na+)<0.100mol·L-1+c(HC2O4-),故C错误;D、 pH=7的溶液中,根据电荷守恒c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-),c(Na+)=2c(C2O42-)+c(HC2O4-),故D错误;故选B。

 互动课堂系列答案
互动课堂系列答案