题目内容
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | A | | |
| B | | | | | | | | | | | | | | | C | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(2)在我们常用的周期表中,氢元素的位置比较尴尬,它是第1列的唯一非金属元素。请写出H2O的电子式: ,氢还能与许多金属形成金属氢化物比如NaH,试分析其中氢元素的化合价为 ,这样看来若把氢元素放在 族也有一定道理。
(3)元素B与元素C形成的化合物中,化学键类型为 。
(4)A、B、C的原子半径由大到小的顺序为 (用元素符号回答)。
(1)氧; 二; VIA ; (2)
(2) ; -1;ⅦA
; -1;ⅦA
(3)离子键 (4)Na > S > O
 (2)
(2) ; -1;ⅦA
; -1;ⅦA(3)离子键 (4)Na > S > O
试题分析:(1)根据元素在周期表中的位置可知,A是氧元素,位于第二周期第ⅥA族,原子结构示意图是
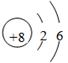 。
。(2)水是含有极性键的共价化合物,电子式是
 。金属钠只有+1价,所以在NaH中氢元素的化合价是-1价,据此可知氢元素放在第ⅦA族也是有道理的。
。金属钠只有+1价,所以在NaH中氢元素的化合价是-1价,据此可知氢元素放在第ⅦA族也是有道理的。(3)元素B与元素C分别是是钠和S,形成的化合物是硫化钠,化学键类型为离子键。
(4)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,则A、B、C的原子半径由大到小的顺序为Na > S > O。
点评:本题主要是元素“位、构、性”三者关系的综合考查,考查学生对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度,有利于培养学生的逻辑推理能力和发散思维能力。

练习册系列答案
相关题目
 ,Y为
,Y为