题目内容
向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g)+3B(g)?xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/,D的平衡浓度为0.3mol/L,又知v(B):v(C)=3:2,则下列说法中正确的是( )A.x:y=2:1
B.v(A):v(C)=2:1
C.A的平衡浓度为0.4mol/L
D.A与B的平衡浓度之比为3:2
【答案】分析:A、根据△c=v△t计算△c(C),结合D的平衡浓度,利用浓度变化量之比等于化学计量数之比确定x:y的值;
B、速率之比等于化学计量数之比,由v(B):v(C)=3:2,故x=2,据此解答;
C、根据D的平衡浓度计算△c(A),A的起始浓度-△c(A)=A的平衡浓度;
D、根据D的平衡浓度计算△c(A)、△c(B),起始浓度-浓度变化量=平衡浓度,据此计算判断.
解答:解:A、△c(C)=0.3mol/(L?min)×2min=0.6mol/L,D的平衡浓度为0.3mol/L,浓度变化量之比等于化学计量数之比,故x:y=0.6mol/L:0.3mol/L=2:1,故A正确;
B、速率之比等于化学计量数之比,由v(B):v(C)=3:2,故x=2,所以v(A):v(C)=2:2=1:1,故B错误;
C、由A、B分析可知y=1,D的平衡浓度为0.3mol/L,故△c(A)=2×0.3mol/L=0.6mol/L,A的平衡浓度为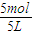 -0.6mol/L=0.4mol/L,故C正确;
-0.6mol/L=0.4mol/L,故C正确;
D、y=1,D的平衡浓度为0.3mol/L,故△c(A)=2×0.3mol/L=0.6mol/L,A的平衡浓度为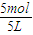 -0.6mol/L=0.4mol/L,
-0.6mol/L=0.4mol/L,
△c(B)=3×0.3mol/L=0.9mol/L,B的平衡浓度为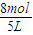 -0.9mol/L=0.7mol/L,故A与B的平衡浓度之比为0.4mol/L:0.7mol/L=4:7,故D错误;
-0.9mol/L=0.7mol/L,故A与B的平衡浓度之比为0.4mol/L:0.7mol/L=4:7,故D错误;
故选AC.
点评:本题考查化学平衡及反应速率的有关计算,难度不大,推断x、y的值是关键,注意基础知识理解掌握.
B、速率之比等于化学计量数之比,由v(B):v(C)=3:2,故x=2,据此解答;
C、根据D的平衡浓度计算△c(A),A的起始浓度-△c(A)=A的平衡浓度;
D、根据D的平衡浓度计算△c(A)、△c(B),起始浓度-浓度变化量=平衡浓度,据此计算判断.
解答:解:A、△c(C)=0.3mol/(L?min)×2min=0.6mol/L,D的平衡浓度为0.3mol/L,浓度变化量之比等于化学计量数之比,故x:y=0.6mol/L:0.3mol/L=2:1,故A正确;
B、速率之比等于化学计量数之比,由v(B):v(C)=3:2,故x=2,所以v(A):v(C)=2:2=1:1,故B错误;
C、由A、B分析可知y=1,D的平衡浓度为0.3mol/L,故△c(A)=2×0.3mol/L=0.6mol/L,A的平衡浓度为
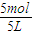 -0.6mol/L=0.4mol/L,故C正确;
-0.6mol/L=0.4mol/L,故C正确;D、y=1,D的平衡浓度为0.3mol/L,故△c(A)=2×0.3mol/L=0.6mol/L,A的平衡浓度为
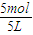 -0.6mol/L=0.4mol/L,
-0.6mol/L=0.4mol/L,△c(B)=3×0.3mol/L=0.9mol/L,B的平衡浓度为
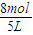 -0.9mol/L=0.7mol/L,故A与B的平衡浓度之比为0.4mol/L:0.7mol/L=4:7,故D错误;
-0.9mol/L=0.7mol/L,故A与B的平衡浓度之比为0.4mol/L:0.7mol/L=4:7,故D错误;故选AC.
点评:本题考查化学平衡及反应速率的有关计算,难度不大,推断x、y的值是关键,注意基础知识理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是
xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是