题目内容
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
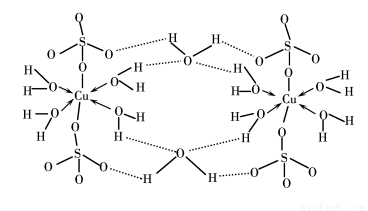
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与
NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________________________________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_________________________________________________________________。
(1)1s22s22p63s23p63d9或[Ar]3d9
(2)4
(3)BD
(4)F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。
(5)高 Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高。
【解析】(1)电子排布为结构化学中的重点。特别是24号、29号等存在半满和全满状态的元素。Cu2+应先写出Cu原子的电子排布,然后从外向内失去2个电子。
(2)对O2-个数的计算,面上的按 算,顶点上按
算,顶点上按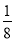 算,棱上按
算,棱上按 算,体心按1个算,可得O2-个数为:
算,体心按1个算,可得O2-个数为: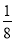 ×8+
×8+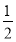 ×2+
×2+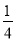 ×4+1=4(个)。
×4+1=4(个)。
(3)H2O中氧原子采用sp3杂化,SO42-中的氧不是。CuSO4应是离子晶体,不是分子晶体。
(4)NH3中是N原子提供孤对电子,Cu2+提供空轨道,形成配位键,而NF3中N原子的孤对电子被N原子核吸引。
(5)离子晶体中,离子键越短,离子键越强,离子化合物熔点越高。