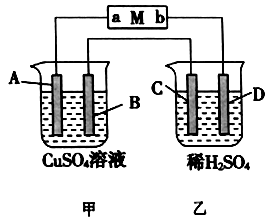
题目内容
【题目】有关电解质溶液下列说法正确的是
A.等体积、等浓度的Na2CO3、NaHCO3溶液混合后,3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
B.常温下pH=2的盐酸和pH=12的氨水等体积混合后c(Cl-)+c(H+)<c(NH4+)+c(OH-)
C.若一元酸酸性HA>HB,则等体积、等浓度的NaA与NaB溶液中,前者的离子总数小于后者
D.将AlCl3溶液、Na2SO3溶液蒸干并灼烧可以得到Al2O3、Na2SO3
【答案】B
【解析】
试题分析:A.等体积、等浓度的Na2CO3、NaHCO3溶液混合后,根据物理守恒,有2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故A错误;B.常温下pH=2的盐酸和pH=12的氨水等体积混合后,氨水过量,溶液显碱性,c(H+)<c(OH-),根据电荷守恒: c(H+)+c(NH4+)=c(OH-) +c(Cl-),则c(Cl-)+c(H+)<c(NH4+)+c(OH-),故B正确;C.根据B-+H2O![]() HB+OH-,水解前后离子的总浓度不变,前者的离子总数等于后者,故C错误;D.Na2SO3检验还原性,容易被空气中的氧气氧化为Na2SO4,蒸干并灼烧得到Na2SO4,故D错误;故选B。
HB+OH-,水解前后离子的总浓度不变,前者的离子总数等于后者,故C错误;D.Na2SO3检验还原性,容易被空气中的氧气氧化为Na2SO4,蒸干并灼烧得到Na2SO4,故D错误;故选B。

【题目】
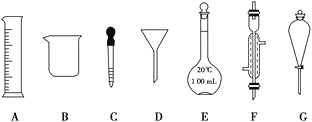
(1)写出仪器名称:D________,F________。
(2)下列实验操作中用到仪器G的是________(填下列选项的编号字母)。]
a.分离水和CCl4的混合物 b.分离水和酒精的混合物 c.分离水和泥沙的混合物
(3)实验室需要配制450mL 0.4 mol/L的硫酸溶液。
①配制时,实验室提供了以下仪器:烧杯、100mL量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是 。上述实验中使用容量瓶前必须进行的操作是
②配制该溶液需用98﹪的浓硫酸(密度为1.8g/mL)___________mL。取用该体积浓硫酸时,需要用到上述仪器中的A和___________(填仪器的编号字母)。
③下列操作会使配制的溶液浓度偏高的是________(填下列选项的编号字母)。
A.转移过程中有少量溶液溅出 |
B.没有冷却,立即转移到容量瓶中定容 |
C.摇匀后,液面下降,补充水 |
D.定容时俯视刻度线 |
E.量筒量取浓硫酸是仰视刻度线