题目内容
常温下,将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L
其中a、b、c、d的关系正确的是( )
| A.b>a=d>c | B.a=b>c>d |
| C.a=b>d>c | D.c>a=d>b |
A
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列溶液中有关物质的浓度关系正确的是( )
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)> c[(NH4)2SO4]> c(NH4Cl) |
| B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.1.0 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
以甲基橙为指示剂,用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,
滴定过程中不可能出现的结果是( )
| A.c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B.c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C.c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D.c(Cl-)>c(NH4+),c(H+)>c(OH-) |
H2O2是一种二元弱酸,对于0.1 mol·L-1的过氧化氢溶液,下列叙述不正确的是( )
A.H2O2的电离方程式可写作H2O2 H++HO2-,HO2- H++HO2-,HO2- H++O42- H++O42- |
| B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大 |
| C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动 |
| D.加入少量氯化铁溶液,溶液中产生大量气泡 |
水的电离过程为H2O H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
| A.c(H+)随着温度的升高而降低 |
| B.35 ℃时c(H+)>c(OH-) |
| C.35 ℃时的水比25 ℃时的水电离程度小 |
| D.水的电离是个吸热过程 |
常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1 mol·L-1NaOH溶液 | pH=11 NaOH溶液 | 0.1mol·L-1 CH3COOH溶液 | pH=3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
常温下,对于1 L 0.005 mol·L-1硫酸表述中正确的是( )
| A.由水电离出的c(H+)=1.0×10-12 mol·L-1 |
| B.加水稀释后,溶液中所有离子的浓度均减少 |
| C.2c(H+)=c(SO42-)+c(OH-) |
| D.滴加稀氨水使pH=7,则c(NH4+)=c(SO42-) |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是( )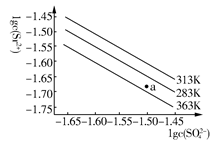
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |