题目内容
18.关于19.6gH2SO4,下列说法错误的是( )| A. | H、S、O三种元素的原子的物质的量之比为2:1:4 | |
| B. | H、S、O三种元素的质量之比为1:16:32 | |
| C. | 含有SO${\;}_{4}^{2-}$为0.2mol,H+为0.4mol | |
| D. | 含原子共1.4mol,质子共10mol,分子为0.2mol |
分析 A.原子物质的量之比等于其原子数目之比;
B.各元素质量之比等于各元素总相对原子质量之比;
C.H2SO4是共价化合物;
D.根据n=$\frac{m}{M}$计算H2SO4的物质的量,结合分子式计算含有原子、质子物质的量.
解答 解:A.H2SO4中H、S、O三种元素的原子的物质的量之比为2:1:4,故A正确;
B.H2SO4中H、S、O三种元素的质量之比为1×2:32:16×4=1:16:32,故B正确;
C.H2SO4是共价化合物,分子中不存在硫酸根离子与氢离子,故C错误;
D.19.6g H2SO4的物质的量为$\frac{19.6g}{98g/mol}$=0.2mol,含有原子物质的量为0.2mol×7=1.4mol、含有质子物质的量为0.2mol×50=10mol,故D正确,
故选:C.
点评 本题考查物质的量有关计算、化学式有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
8.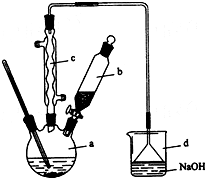 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;第二次用水洗涤的作用是洗去NaOH.分液时C,(填序号).
A.直接将溴苯从分液漏斗上口倒出
B.直接将溴苯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将溴苯从下口放出
D.先将水层从分液漏斗的下口放出,再将溴苯从上口倒出
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是作干燥剂;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)该反应是否要加热C(填下列字母)
A.直接加热 B.水浴加热 C.不需加热
(6)粗溴苯经分离提纯后得纯溴苯为3.9g,则溴苯产率是32%(取整数).
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;第二次用水洗涤的作用是洗去NaOH.分液时C,(填序号).
A.直接将溴苯从分液漏斗上口倒出
B.直接将溴苯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将溴苯从下口放出
D.先将水层从分液漏斗的下口放出,再将溴苯从上口倒出
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是作干燥剂;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL
(5)该反应是否要加热C(填下列字母)
A.直接加热 B.水浴加热 C.不需加热
(6)粗溴苯经分离提纯后得纯溴苯为3.9g,则溴苯产率是32%(取整数).
6.只用一种试剂便可将苯、苯酚、四氯化碳、乙醛4种无色液体进行鉴别,这种试剂是( )
①银氨溶液
②新制的Cu(OH)2悬浊液
③NaOH溶液
④溴水.
①银氨溶液
②新制的Cu(OH)2悬浊液
③NaOH溶液
④溴水.
| A. | 仅①④ | B. | 仅②③ | C. | ①②③④ | D. | 仅①②④ |
13.常温下,下列叙述不正确的是( )
| A. | c(H+)>c(OH-)的溶液一定显酸性 | |
| B. | pH=3的弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性 | |
| C. | pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO${\;}_{4}^{2-}$)与c(H+)之比约为1:10 | |
| D. | 中和10 mL 0.1 mol/L醋酸与100 mL 0.01 mol/L醋酸所需NaOH的物质的量不同 |
3.在强酸性溶液中,下列离子能大量共存的组合为( )
| A. | HCO3-、Ca2+、Ba2+、Na+ | B. | Ca2+、NO3-、Mg2+、SO42- | ||
| C. | Fe3+、Cu2+、NO3-、Cl-C | D. | SO32-、MnO4-、S2-、Na+ |
10.下列离子方程式错误的是( )
| A. | 氯气通入水中:Cl2+H2O═H++Cl-+HClO | |
| B. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 硫酸与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| D. | CO2通入足量澄清的石灰水中:Ca2++CO2+2OH-═CaCO3↓+H2O |
8.下列过程属于熵减少的过程的是( )
| A. | 硝酸钾溶解在水里面 | |
| B. | 碳酸铵分解生成二氧化碳、氨气和水 | |
| C. | 水蒸气凝结为液态的水 | |
| D. | 氨气和氯化氢反应生成氯化铵晶体 |
 .
.