题目内容
按图4-7装置进行实验,并回答下列有关问题。
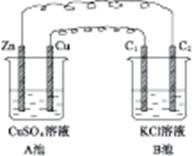
图4-7
(1)判断装置的名称:A池为 ,B池为 。
(2)锌为 极,电极反应式为 。铜为 极,电极反应式为 。石墨棒C1为 极,电极反应式为 。石墨棒C2为 极,电极反应式为 。
(3)当C2极上析出224 mL气体(标准状况)时,锌的质量变化了(“增加”或“减少”) g,CuSO4溶液的质量变化了(“增加”或“减少”) g。
(1)原电池电解池
(2)负Zn-2e-![]() Zn2+
Zn2+
正Cu2++2e-![]() Cu
Cu
阳4OH--4e-![]() 2H2O+O2↑
2H2O+O2↑
阴4H++4e-![]() 2H2↑
2H2↑
(3)减少0.65 增加0.01
解析:
A池中Zn、Cu放入CuSO4溶液中,它们构成原电池。B池中,两个电极均为石墨电极,在以A池为电源的情况下构成电解池。即以A为原电池来带动B电解池。A池中Zn为负极,Cu为正极;B池中C1为阳极,C2为阴极,C2极上析出的气体为H2,C2极上析出H2为![]() =0.01 mol。
=0.01 mol。
电路上转移电子物质的量为0.01 mol×2=0.02 mol。
因得失电子守恒,故Zn极上有0.01 mol的Zn溶解,即Zn极质量减少0.01 mol×65 g·mol-1=0.65 g。
Cu极上有0.01 mol的Cu析出,即CuSO4溶液的质量增加了0.01 mol×(65-64) g·mol-1=0.01 g。

 字词句段篇系列答案
字词句段篇系列答案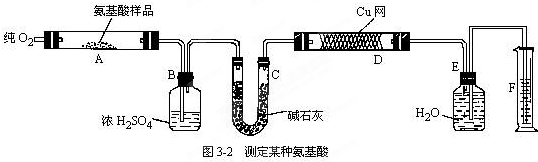
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2