题目内容
16.对于反应H2(g)+I2(g)?2HI(g),能量变化如图所示,下列说法不正确的是( )
| A. | 该反应是放热反应 | B. | 升高温度平衡向逆反应方向移动 | ||
| C. | 增大压强,平衡不发生移动 | D. | 升高温度,反应的平衡常数K增大 |
分析 对于反应H2(g)+I2(g)?2HI(g),由能量变化图可知反应物总能量大于生成物总能量,为放热反应,升高温度,平衡逆向移动,平衡常数减小,反应前后气体的物质的量不变,增大压强,平衡不移动,以此解答该题.
解答 解:A.由能量变化图可知反应物总能量大于生成物总能量,为放热反应,故A正确;
B.为放热反应,升高温度,平衡逆向移动,故B正确;
C.反应前后气体的物质的量不变,增大压强,平衡不移动,故C正确;
D.升高温度,平衡逆向移动,平衡常数减小,故D错误.
故选D.
点评 本题综合考查化学反应与能量变化以及化学平衡的移动的问题,为高频考点,侧重考查学生的分析能力,主要把握图象的分析以及反应的特征,把握影响平衡移动的因素,难度不大.

练习册系列答案
相关题目
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 2.24 L CH4中含碳原子数目是0.1 NA | |
| B. | 0.1 mol•L-1 NaNO3溶液中含Na+数目是0.1 NA | |
| C. | 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA | |
| D. | 标准状况下,22.4 L苯中含分子数目是NA |
7.下列说法不正确的是( )
| A. | 环戊二烯(  )分子中所有碳原子共平面 )分子中所有碳原子共平面 | |
| B. | 正丁烷与异丁烷互为同分异构体的依据是它们的分子式相同,但分子内碳原子的连接方式不同 | |
| C. | 七叶内酯( )和东莨菪内酯( )和东莨菪内酯( )都是某些中草药中的成分,它们具有相同的官能团,互为同系物 )都是某些中草药中的成分,它们具有相同的官能团,互为同系物 | |
| D. | 有机物(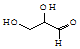 )不能与氢氧化钠发生中和反应,但能发生取代反应 )不能与氢氧化钠发生中和反应,但能发生取代反应 |
4.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NH3>H2O>N2>CO | D. | HF>HCl>HBr>HI |
11.常温下,PH=12的Ba(OH)2 溶液,下列说法不正确( )
| A. | 此溶液中由水电离C(OH-)=1×10-12mol/L | |
| B. | 加入等体积PH=2 CH3COOH溶液后溶液呈中性 | |
| C. | 此溶液中C(OH-)=1×10-2mol/L | |
| D. | 加水稀释100后,溶液的PH=10 |
4.足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成.现有甲乙两研究小组分别实验探究:
(1)甲研究小组按图1实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol•L-1的浓硫酸,经过一段时间反应,Zn完全溶解

①填写仪器名称:a分液漏斗、b圆底烧瓶
②写出装置A中生成能使品红溶液褪色的化学反应方程式:Zn+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+2H2O+SO2↑.
③装置D中加入的试剂是浓硫酸.
④U型管G的作用为防止空气中的水蒸气进入干燥管影响杂质气体的检验,干扰实验.
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为防止倒吸.
⑥证明反应生成SO2和H2的实验现象是B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝.
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1mol•L-1,则稀释液中SO42-的物质的量浓度是1.55 mol•L-1.
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行图2所示实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素.
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高是主要影响因素,故反应速率更快.
(1)甲研究小组按图1实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol•L-1的浓硫酸,经过一段时间反应,Zn完全溶解

①填写仪器名称:a分液漏斗、b圆底烧瓶
②写出装置A中生成能使品红溶液褪色的化学反应方程式:Zn+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+2H2O+SO2↑.
③装置D中加入的试剂是浓硫酸.
④U型管G的作用为防止空气中的水蒸气进入干燥管影响杂质气体的检验,干扰实验.
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为防止倒吸.
⑥证明反应生成SO2和H2的实验现象是B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝.
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1mol•L-1,则稀释液中SO42-的物质的量浓度是1.55 mol•L-1.
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行图2所示实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素.
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高是主要影响因素,故反应速率更快.
11.肾上腺素的一种合成路线如下:

下列说法正确的是( )

下列说法正确的是( )
| A. | X的化学名称是间苯二酚 | |
| B. | 反应①、②、③均为取代反应 | |
| C. | Y能发生加成反应和水解反应 | |
| D. | 肾上腺素既能与强碱反应又能与强酸反应 |
8.下列实验中,反应速率增大是由催化剂引起的是( )
| A. | 双氧水中加入少量MnO2,即可迅速放出气体 | |
| B. | 锌与稀硫酸反应中加入少量CuSO4溶液,反应放出H2的速率加快 | |
| C. | 固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 在炭粉中加入KClO3,点燃时燃烧更为剧烈 |