题目内容
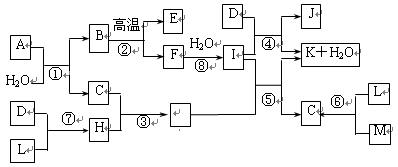
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件和产物未列出。已知C、D、E、H是常见的气体且D为单质。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法,反应⑥是J的失效反应原理。
请回答下列问题:
⑴物质L的电子式为____________,E的结构式为_______________。
⑵D所含元素位于周期表__________________,生产D的工业被称为_______________。
⑶反应⑤的化学方程式为___________________________________________。
反应⑥的离子方程式为___________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为________。
⑴ ![]() O=C=O(2分)⑵第三周期VIIA族,氯碱工业(2分)
O=C=O(2分)⑵第三周期VIIA族,氯碱工业(2分)
⑶Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O(2分)
CaCl2+2NH3↑+2H2O(2分)
Ca2++2ClO—+CO2+H2O=CaCO3↓+2HClO(2分) ⑷CaCN2(2分)
解析:
本题突破口为:反应⑥是J的失效反应原理,中学阶段只有漂白粉符合题意,∴J为Ca(ClO)2。又知D为常见气体单质,D+I→J+K+H2O,且反应②④是工业生产中的重要反应,可推知,D为Cl2,I为Ca(OH)2,④是工业制漂白粉的重要反应。∵F+H2O→I,∴F为CaO, B为CaCO3,②为工业煅烧石灰石。再由反应⑤是实验室制备气体C的重要方法,I+G →C+K+H2O∴C为氨气,G为NH4Cl,C+H→NH4Cl,所以H为HCl。本题难点是确定物质A组成,由1molA与水反应生成1molB和2molC知:A+H2O→CaCO3+2NH3,据原子守恒知H2O系数为3,∴A为CaCN2。


 两容积相等的密闭容器。
两容积相等的密闭容器。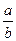 ________
________ 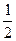 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。