题目内容
设NA为阿伏加德罗常数,下列说法错误的是
| A.常温常压下,16 g由O2和O3组成的混合气体所含电子数为8NA |
| B.2 g2H216O含有的共用电子对数目为0.2NA |
| C.常温常压下,11.2L H2中含有的电子数为NA |
| D.3 mol NO2与足量H2O反应,转移的电子数为2NA |
C
分析:A、16gO2和gO3混合气体都是由元素组成,12g质量为氧元素质量,根据n=
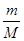 计算氧原子的物质的量,每个氧原子含有8个电子,再根据N=nNA计算电子数;
计算氧原子的物质的量,每个氧原子含有8个电子,再根据N=nNA计算电子数;B、根据根据n=
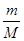 计算水的物质的量,每个水分子中含有2对共用电子对,再根据N=nNA计算共用电子对数;
计算水的物质的量,每个水分子中含有2对共用电子对,再根据N=nNA计算共用电子对数;C、氢气所处的状态不是标准状况,不能使用气体摩尔体积22.4L/mol;
D、根据方程式可知3molNO2与足量H2O反应,生成2mol硝酸与1mol一氧化氮,起氧化剂作用的NO2为1mol,氮元素化合价由+4价降低为+2价,根据N=nNA计算转移电子数.
解:A、16gO2和gO3混合气体都是由元素组成,氧原子物质的量为
 =1mol,每个氧原子含有8个电子,所以16gO2和gO3混合气体含有的电子数为1mol×8×NAmol-1=8NA,故A正确;
=1mol,每个氧原子含有8个电子,所以16gO2和gO3混合气体含有的电子数为1mol×8×NAmol-1=8NA,故A正确;B、2g2H216O的物质的量为
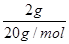 =0.1mol,每个水分子中含有2对共用电子对,所以2g2H216O中含有共用电子对数为0.1mol×2×NAmol-1=0.2NA,故B正确;
=0.1mol,每个水分子中含有2对共用电子对,所以2g2H216O中含有共用电子对数为0.1mol×2×NAmol-1=0.2NA,故B正确;C、氢气所处的状态不是标准状况,气体摩尔体积不为22.4L/mol,故C错误;
D、由方程式3NO2+H2O=2HNO3+NO可知,3molNO2与足量H2O反应,生成2mol硝酸与1mol一氧化氮,起氧化剂作用的NO2为1mol,氮元素化合价由+4价降低为+2价,转移电子数为1mol×(4-2)×NAmol-1=2NA,故D正确.
故选C.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
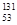 I愿子中含电子数为7.8NA
I愿子中含电子数为7.8NA
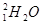 )中含有10nA个个电子
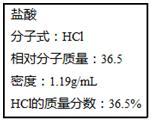
)中含有10nA个个电子 ,试根据标签上的有关数据回答下列问题:
,试根据标签上的有关数据回答下列问题: