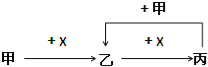
题目内容
【题目】Ⅰ、某学生设计了一个实验以证明PbO中含有氧,反应方程式如下:
① PbO + C![]() Pb + CO (主要)
Pb + CO (主要)
② PbO + CO![]() Pb + CO2
Pb + CO2
③〔Cu (NH3 )2〕Ac + CO +NH3![]() 〔Cu (NH3 )3〕Ac·CO;△H<0(Ac-代表醋酸根离子此反应无明显现象)
〔Cu (NH3 )3〕Ac·CO;△H<0(Ac-代表醋酸根离子此反应无明显现象)
试根据下图回答问题:

(1) 盛澄清石灰水的试管开始一段时间可能没有现象,其原因是 。
(2) 烧杯中醋酸二氨合铜 (〔Cu (NH3 )2〕Ac ) 的作用为 。
(3) 实验后的醋酸二氨合铜经适当处理又可再生,适宜于再生的生产条件是 。(说明;不能加药品仅从生产条件考虑,以节约成本)
Ⅱ、图像分析是化学研究的一种重要的手段。某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出)。请回答:
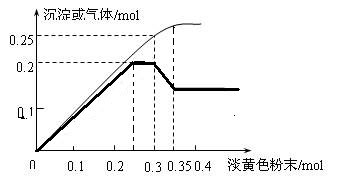
(1)根据图像所示,推测溶液中肯定有_____________离子。(写化学式)
(2)请写出曲线中过氧化钠物质的量在0.3~0.35mol时,粗的曲线出现下滑的现象,请用两个离子反应方程式解释该过程___________________,_________________.
(3)溶液中离子的物质的量之比为___________ 。
【答案】
Ⅰ(1)开始主要是发生反应①,生成的二氧化碳很少;
(2)吸收一氧化碳,防污染
(3)加热、降压
Ⅱ(1)Mg2+、Al3+、NH4+;
(2)2Na2O2+2H2O═4Na++4OH-+O2↑;Al(OH)3+OH-═AlO2-+2H2O;
(3)1:1:1
【解析】
试题分析:Ⅰ、(1) 开始主要是发生反应①,生成的二氧化碳很少,造成盛澄清石灰水的试管开始一段时间没有明显现象,故答案为:开始主要是发生反应①,生成的二氧化碳很少;
(2) 根据反应③,生成的一氧化碳能够被醋酸二氨合铜吸收,防止一氧化碳污染空气,故答案为:吸收一氧化碳,防污染;
(3) 根据反应③,实验后的醋酸二氨合铜经适当处理又可再生,需要使平衡逆向移动,可以加热,降低压强,故答案为:加热、降压;
Ⅱ、(1)淡黄色粉末是过氧化钠,溶液时无色透明,排除铁离子和铜离子,首先加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,当加入过氧化钠时,生成白色沉淀,推断一定有Mg2+,沉淀的物质的量达到0.2mol时,继续加入过氧化钠,沉淀的量不变,说明含有NH4+,通过图象知,在加入过量的过氧化钠的过程中,沉淀部分溶解,推断一定含有Al3+,氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱,最终的白色沉淀的成分是氢氧化镁,根据加入过氧化钠的量的增加生成气体的量会变化,所以产生的气体应含有除氧气以外的一种气体,即为氨气,一定含有铵根离子,故答案为:Mg2+、Al3+、NH4+;
(2)过氧化钠和水反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,氢氧化铝可以和氢氧化钠发生反应,即Al(OH)3+OH-═AlO2-+2H2O;
(3)加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,在0.3-0.35mol这一段内,共溶解氢氧化铝沉淀0.1mol,则根据Al3+~Al(OH)3~[Al(OH)4]-,所以铝离子的物质的量是0.1mol,在0~0.3mol过氧化钠这一段,生成沉淀量最大,是氢氧化镁和氢氧化铝的混合物,所以含有氢氧化镁也是0.1mol,根据Mg2+~Mg(OH)2,所以镁离子的物质的量是0.1mol,根据气体的量,当加入0.3mol过氧化钠时,理论上会产生0.15mol的氧气,此时生成气体共0.25mol,所以会生成0.1mol的氨气,根据NH4+~NH3↑,铵根离子的物质的量为:0.1mol,所以各种离子浓度只比是1:1:1,故答案为:1:1:1。

【题目】下图是实验室制乙酸乙酯的装置。
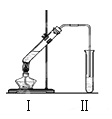
(1)加热前,通常需要在试管Ⅰ中加入碎瓷片,目的是 。
(2)为了证明浓硫酸的作用,某同学进行了以下4个
实验,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18molL﹣1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL3molL﹣1硫酸 | 饱和Na2CO3溶液 | 1.2 |
D | 3mL乙醇、2mL乙酸、6mL6molL﹣1盐酸 | 饱和Na2CO3溶液 | 1.2 |
①为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴 试液,每次实验结束后可观察到试管Ⅱ中的现象是 ,
②分析实验A、B、C的数据,可以得出浓硫酸在反应中的作用是 、 ;实验D和实验C对照,你又能得出的结论是 。
(3)饱和Na2CO3溶液的作用是____________________、___________。