��Ŀ����
��ʯ��һ�־��ж�ṹ���������Σ�NaAlSiO4?nH2O����������������״��Ѩ��ͨ������ֱ���ȿ�ѨС�ķ���ͨ��������ķ����������棬���ֳơ�����ɸ����������ɸ���ڱ��滯ѧ������Ҫ���ã�����Ҫ�Ĵ����ʹ������壮�Ը���������Ҫ�ɷ֣�Al2Si2O7?2H2O����ʯ��ʯ����ˮΪԭ������������ɸ���Ĺ����������£�
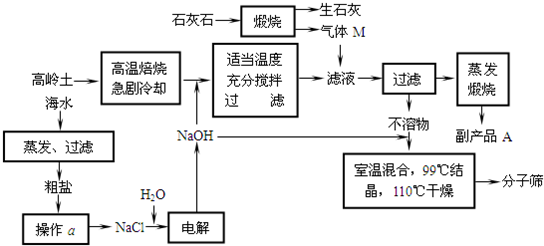
�ش���������
��1����������Ҫ�ɷֵĻ�ѧʽ�ɱ�ʾΪAl2O3?2SiO2?2H2O�������ɸ�Ļ�ѧʽҲ�ɱ�ʾΪ ��
��2��д��0.1mol/L����ƷA��Һ���й�����Ũ�ȹ�ϵ��������ʽ�� �� ��
��3������M����Һ������Ӧ������һ�����ӷ���ʽΪ�� ��
��4�����ö��Ե缫��ⱥ��NaCl��Һһ��ʱ�䣬����������56L����״���£����壬������Һ���Ϊ500Lʱ����������Һ�ڳ���ʱ��pHֵ��Ҫ��д��������̣��� ��

�ش���������
��1����������Ҫ�ɷֵĻ�ѧʽ�ɱ�ʾΪAl2O3?2SiO2?2H2O�������ɸ�Ļ�ѧʽҲ�ɱ�ʾΪ
��2��д��0.1mol/L����ƷA��Һ���й�����Ũ�ȹ�ϵ��������ʽ��
��3������M����Һ������Ӧ������һ�����ӷ���ʽΪ��
��4�����ö��Ե缫��ⱥ��NaCl��Һһ��ʱ�䣬����������56L����״���£����壬������Һ���Ϊ500Lʱ����������Һ�ڳ���ʱ��pHֵ��Ҫ��д��������̣���
��������1��������д����������ʽʱ��д������˳���ǣ����ý���������ϻ��ý���������������衢ˮ��Ҫע��ԭ���غ㣻
��2��ʯ��ʯ�������ɵ�����MΪCO2�����������պ�IJ�����Ҫ��SiO2��Al2O3����NaOH���˺�õ�����ҺN��Ҫ����NaAlO2��Na2SiO3��������̼��ƫ�����ơ���������Һ��Ӧ���ɷֱ����������������̼���ƣ����Ը���ƷA�к���̼���ƣ���Һ�д��ڵ���غ�������غ㣻
��3��������̼��ƫ�����ơ������ƶ�������Ӧ���ɳ�����
��4���ö��Ե缫����Ȼ�����Һʱ�������������ӷŵ����������������������ӷŵ�����������������������������֮��Ĺ�ϵʽ�����������Ƶ����ʵ������ٸ���C=
�����������Ƶ����ʵ���Ũ�ȣ��Ӷ�������Һ��pH��
��2��ʯ��ʯ�������ɵ�����MΪCO2�����������պ�IJ�����Ҫ��SiO2��Al2O3����NaOH���˺�õ�����ҺN��Ҫ����NaAlO2��Na2SiO3��������̼��ƫ�����ơ���������Һ��Ӧ���ɷֱ����������������̼���ƣ����Ը���ƷA�к���̼���ƣ���Һ�д��ڵ���غ�������غ㣻
��3��������̼��ƫ�����ơ������ƶ�������Ӧ���ɳ�����
��4���ö��Ե缫����Ȼ�����Һʱ�������������ӷŵ����������������������ӷŵ�����������������������������֮��Ĺ�ϵʽ�����������Ƶ����ʵ������ٸ���C=
| n |
| V |
����⣺��1��������д����������ʽʱ��д������˳���ǣ����ý���������ϻ��ý���������������衢ˮ�����Է���ɸ�ı�ʾʽΪ��Na2O?Al2O3?2SiO2?2nH2O��
�ʴ�Ϊ��Na2O?Al2O3?2SiO2?2nH2O��
��2��ʯ��ʯ�������ɵ�����MΪCO2�����������պ�IJ�����Ҫ��SiO2��Al2O3����NaOH���˺�õ�����ҺN��Ҫ����NaAlO2��Na2SiO3��������̼��ƫ�����ơ���������Һ��Ӧ�ֱ��������������������̼���ƣ����Ը���ƷA�к���̼���ƣ���Һ�д��ڵ���غ�������غ㣬���������غ��C��Na+��=2C��CO32-��+2C��HCO3-��+2C��H2CO3�������ݵ���غ��C��Na+��+C��H+��=2C��CO32-��+C��HCO3-��+C��OH-����
���������غ��2C��H2CO3��+C��HCO3-��+C��H+��=C��OH-����
�ʴ�Ϊ��C��Na+��=2C��CO32-��+2C��HCO3-��+2C��H2CO3����C��Na+��+C��H+��=2C��CO32-��+C��HCO3-��+C��OH-����
��3��������̼��ƫ�����ơ���������Һ��Ӧ�ֱ��������������������̼���ƣ�
���ӷ�Ӧ����ʽΪ��CO2+2AlO2-+3H2O=2Al��OH��3��+CO32-����CO2+AlO2-+2H2O=Al��OH��3��+HCO3-��
��CO2+SiO32-+H2O=H2SiO3��+CO32-����2CO2+SiO32-+2H2O=H2SiO3��+2HCO3-����
�ʴ�Ϊ��CO2+2AlO2-+3H2O=2Al��OH��3��+CO32-����CO2+AlO2-+2H2O=Al��OH��3��+HCO3-��
��CO2+SiO32-+H2O=H2SiO3��+CO32-����2CO2+SiO32-+2H2O=H2SiO3��+2HCO3-����
��4����״����56L���������ʵ���Ϊ2.5mol�����ʱ��Һ������NaOH�����ʵ���Ϊx
��2NaCl+2H2O
2NaOH+Cl2��+H2��
2 1
x 2.5mol
2��1=x��2.5mol����x=5.0mol
500L��Һ��C��OH-��=
=0.01mol/L
��Һ��C��H+��=
mol/L=10-12mol/L��������Һ��pH=-lg10-12=12��
�ʴ�Ϊ��12��
�ʴ�Ϊ��Na2O?Al2O3?2SiO2?2nH2O��
��2��ʯ��ʯ�������ɵ�����MΪCO2�����������պ�IJ�����Ҫ��SiO2��Al2O3����NaOH���˺�õ�����ҺN��Ҫ����NaAlO2��Na2SiO3��������̼��ƫ�����ơ���������Һ��Ӧ�ֱ��������������������̼���ƣ����Ը���ƷA�к���̼���ƣ���Һ�д��ڵ���غ�������غ㣬���������غ��C��Na+��=2C��CO32-��+2C��HCO3-��+2C��H2CO3�������ݵ���غ��C��Na+��+C��H+��=2C��CO32-��+C��HCO3-��+C��OH-����
���������غ��2C��H2CO3��+C��HCO3-��+C��H+��=C��OH-����
�ʴ�Ϊ��C��Na+��=2C��CO32-��+2C��HCO3-��+2C��H2CO3����C��Na+��+C��H+��=2C��CO32-��+C��HCO3-��+C��OH-����
��3��������̼��ƫ�����ơ���������Һ��Ӧ�ֱ��������������������̼���ƣ�
���ӷ�Ӧ����ʽΪ��CO2+2AlO2-+3H2O=2Al��OH��3��+CO32-����CO2+AlO2-+2H2O=Al��OH��3��+HCO3-��
��CO2+SiO32-+H2O=H2SiO3��+CO32-����2CO2+SiO32-+2H2O=H2SiO3��+2HCO3-����
�ʴ�Ϊ��CO2+2AlO2-+3H2O=2Al��OH��3��+CO32-����CO2+AlO2-+2H2O=Al��OH��3��+HCO3-��
��CO2+SiO32-+H2O=H2SiO3��+CO32-����2CO2+SiO32-+2H2O=H2SiO3��+2HCO3-����
��4����״����56L���������ʵ���Ϊ2.5mol�����ʱ��Һ������NaOH�����ʵ���Ϊx
��2NaCl+2H2O
| ||
2 1
x 2.5mol
2��1=x��2.5mol����x=5.0mol
500L��Һ��C��OH-��=
| 5mol |
| 500L |
��Һ��C��H+��=
| 1��10-14 |
| 0.01 |
�ʴ�Ϊ��12��
���������⿼���˹������̣��漰���ӷ�Ӧ����ʽ����д������ԭ��������Ũ�ȴ�С�ıȽϵ�֪ʶ�㣬�ۺ��Խ�ǿ�����������غ㼰����غ�ȷ������Ũ�ȴ�С�������������ǿ��ȷ�����ӷ�Ӧ����ʽ���Ӷ���ȷ����Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
 �������˽��ơ������赡��ϵĻ������Dz����½��ĺ�����������һ�־�����״�ṹ�ĺ�ˮ��þ�����Σ�ij�ֺ�����Ļ�ѧ�ɷ�ΪCa2Mg3Fe2��Si4O11��2��OH��2�������й���������ȷ���ǣ�������
�������˽��ơ������赡��ϵĻ������Dz����½��ĺ�����������һ�־�����״�ṹ�ĺ�ˮ��þ�����Σ�ij�ֺ�����Ļ�ѧ�ɷ�ΪCa2Mg3Fe2��Si4O11��2��OH��2�������й���������ȷ���ǣ�������| A�����ú�����Ļ�ѧʽ��д�����������ʽ��ʾ���£�2CaO?3MgO?Fe2O3?8SiO2?H2O | B���ú������ֿܵ��κ�����ĸ�ʴ | C���ú�������Fe�Ļ��ϼ�Ϊ+2�� | D���ú���������5����������ɵĻ���� |

